研究人员开发了针对KRAS突变癌症的新策略
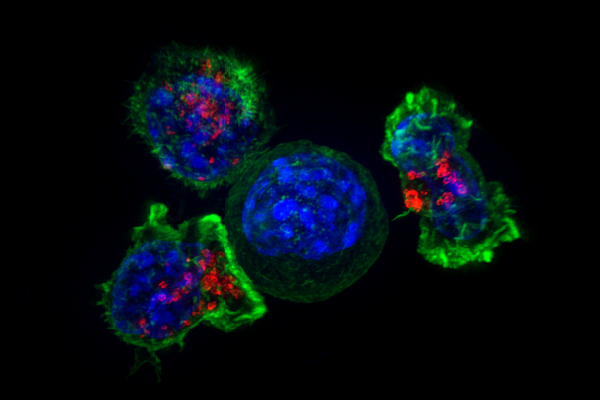
尽管KRAS是与侵袭性癌症相关的主要致癌基因之一,但设计阻断KRAS功能的药物并不能在临床环境中阻止癌症的进展。到目前为止,KRAS一直是臭名昭著的“不可用药”。
在本月发表的一项新研究中癌症发现美国加州大学圣地亚哥分校医学院的研究人员报告说,大约一半的肺和胰腺癌源于KRAS突变的突变在进展时沉迷于基因。通过了解导致这些癌症仍然依赖于克拉的机制,他们能够识别能够瞄准它的药物。
“某些肿瘤使用突变克拉斯通过帮助他们培养营养和过程毒素来增强它们的生存,导致他们沉迷于克拉斯,”博士博士,博士,博士医学院杰出教授的病理学和高级作者教授纸。“其他不使用KRA的肿瘤可以在没有它的情况下,即使需要启动癌症。根据我们发现的生物标志物,我们现在知道哪些癌症将被沉迷并且不会。“
目前对于95%的胰腺癌和多达30%的KRAS突变的非小细胞肺癌没有有效的治疗方法。研究小组发现,蛋白Galectin-3与细胞表面受体整合素avb3的结合放大了KRAS突变体驱动的优势,创造了一种独特的脆弱性,可用于现有药物的靶向。
ChESH和团队发现,Galectin-3名为GCS-100的抑制剂能够杀死KRAS上瘾的细胞在体外并在小鼠模型中阻止kras依赖性肿瘤的进展。重要的是,他们发现肿瘤只有整合素αvb3阳性时才对药物有反应。
“这可能是成功靶向KRAS突变癌的第一种方法之一。此前,我们不明白为什么只有某些KRAS启动的癌症仍将沉迷于突变,”UC SAN的创新与工业联盟副主任Cheresh表示迭戈系泊癌症中心。“现在我们理解整合蛋白αvb3的表达为kras创造了瘾。那些我们认为最容易使用Galectin-3抑制剂靶向该途径的上瘾癌症。”
中断该途径的起源可能比试图阻止单独的克拉斯驱动的功能更有希望,写了研究人员。考虑到KRAS-上瘾的癌症在临床前模型中对Galectin-3抑制剂非常敏感,下一步将是临床测试肿瘤表达突变体KRAS和αvB3,伴侣生物标志物的患者中当前可用的Galectin-3抑制剂预测响应。
KRAS突变影响大量癌症患者。如果患者患有KRAS突变型癌症,并且该癌症也呈αvb3阳性,那么该患者可能是靶向该途径的治疗候选。”Cheresh说。“我们的工作提出了一种个性化的药物方法来识别和开发KRAS成瘾肿瘤,提供了一个新的机会来停止目前没有可行的靶向治疗方案的肿瘤的进展。”
进一步探索











用户评论