研究人员有助于败血症心力衰竭和死亡率的揭示机制

美国每年有近100万人感染败血症,其中近五分之一的人死亡。心血管并发症约占死亡人数的80%。由于全身炎症而变得虚弱的心肌无法产生收缩所需的能量,导致向组织输送的血液流量和氧气严重下降,最终导致器官衰竭。现在,在新的工作中,科学家路易斯Katz天普大学医学院(LKSOM),与同事合作在纽约哥伦比亚大学(Columbia University),描述了机制从心脏功能障碍在脓毒症的损失能量,为新疗法的发展开辟了道路,每年可以挽救成千上万人的生命。
“败血症是由感染引起的,刺激强大的炎症反应,导致氧化压力增加心肌肉细胞,“Konstantinos Drosatos,博士学位,博士学位,助理医学中心药理和助理教授助理教授,并在新研究中的高级调查员和高级调查员。”,抗炎疗法未能提高生存。我们认为这种情况发生,因为在临界器官开始失败之前,抗炎药物就没有足够的时间开始工作。“
他们的新研究发表在9月7日的杂志上JCI Insight., Drosatos博士和他的同事们提出了一种新的方法来扩大消炎治疗发挥作用的机会窗口。在脓毒症小鼠模型中,研究人员表明,阻断心脏中被称为NADPH氧化酶2 (NOX2)的酶的激活可以降低氧化应激,从而允许心脏能源生产将恢复到接近正常的水平。研究结果表明,NOX2抑制,与现有的败血症疗法一起使用,可以显著提高患者的生存率。
该研究在德罗斯托斯博士和同事博士的早期工作中建立了先前的工作,他是第一个在理解败血症中作为一种替代角度堵塞能源生产的能源生产。在以前使用败血鼠的小鼠模型的两项研究中,他们能够表明心脏中的刺激能量产生可以纠正心脏功能障碍并可能改善存活。然而,心脏功能障碍与败血症之间的机械连接仍然不清楚。
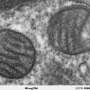
德罗斯托斯博士和同事Mudesh Muniswamy,博士,医学遗传学和分子生物化学系教授,Laysom,哥伦比亚医学院医学助理教授John P.Molor,MD。纽约大学是新报告中的共同高级作者,决定将其最近的努力集中在NOX2上,因为它的激活导致生产活性氧,这构成了心脏中氧化胁迫的主要来源。“活性氧物种的水平增加是一个关键特征心脏功能障碍在败血症期间,“Drosatos博士说。”线粒体,细胞的能量动力剧,特别容易受到反应性分子的损伤,这似乎对心脏的能量产生至关重要。“
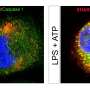
为了阐明NOX2活化,增加的活性氧物质,线粒体损伤的关系能源生产在心肌细胞在败血症期间,研究人员首先在用内毒素脂多糖(LPS)处理的孤立的小鼠心肌细胞中进行实验,该脂多糖(LPS)诱导败血症状状态。一旦细胞表现出败血症的变化,包括升高的氧化应激水平,用NOx2抑制剂处理细胞。抑制剂阻止了LPS的NOx活化,导致降低氧化应激。随后在小鼠中进行了类似的实验,其中通过超声心动图测量显示用NOx2抑制剂处理的脓毒症中的保存心脏功能。
“目前,待遇的主要方法败血症是支持的,”Drosatos医生说。“根据我们的最新发现,支持性和抗炎治疗仍将是主流,但通过确保心脏产生能量,我们可以在心脏衰竭前为治疗提供额外的时间。”
Drosatos博士和同事们现在正将注意力转向人类,扩大对人类细胞的研究。他说:“如果治疗是有益的,就像在老鼠身上所做的那样,我们希望很快就能与临床小组互动,将我们的研究成果应用到人类患者身上。”
进一步探索







用户评论