帕金森蛋白和生长因子之间的拉锯战
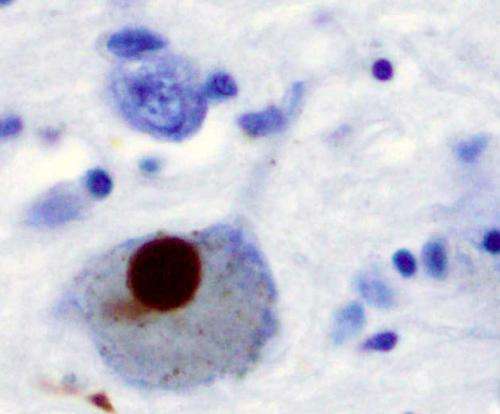
埃默里大学的研究人员发现,α -突触核蛋白是一种粘性的,有时是有毒的蛋白质,与帕金森病(PD)有关,它可以阻断一种重要的大脑生长因子的信号。
研究结果将于PNAS.
这一发现进一步证明α-突触核蛋白是帕金森病中脑细胞损伤的枢纽,并有助于解释为什么大脑细胞会产生神经递质多巴胺更容易退化。
α -突触核蛋白是路易体的主要组成部分,路易体是帕金森病的病理标志。此外,编码α -突触核蛋白的基因的重复或突变导致了一些罕见的家族病例。
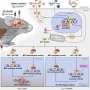
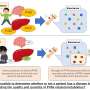
在目前的论文中,由叶克强博士领导的研究人员证明,α -突触核蛋白结合并干扰了BDNF(脑源性神经营养因子)的受体TrkB。BDNF促进脑细胞存活,已知帕金森患者缺乏BDNF。当应用于神经元时,BDNF反过来将α -突触核蛋白从TrkB中发送出去。
因此,α -synuclein和BDNF之间存在着一种“拉锯战”的局面,争夺对TrkB的主导地位。在培养的神经元和小鼠中,α -突触核蛋白抑制BDNF的保护能力大脑细胞叶的团队发现,这些毒素可以模拟pd相关的损伤。
以前,过多的α -突触核蛋白被认为会干扰神经元功能的其他方面,如神经递质合成和突触重塑。科学家们提出,“寡聚体”α -突触核蛋白(几个蛋白质分子结合在一起)比单个分子的毒性更大。
Ye说,目前尚不清楚低聚α -突触核蛋白是否比单体与TrkB更紧密地结合。然而,α -synuclein与TrkB之间的相互作用可以在大脑路易体痴呆患者的样本,其中聚集的α -突触核蛋白丰富,但在对照样本中没有。
此外,α -突触核蛋白和TrkB之间的相互作用似乎对目前的PD治疗有反应。产生多巴胺的神经元对帕金森病的退化更敏感,部分原因是多巴胺本身是细胞内一种反应性和潜在毒性的化学物质。
在过度产生α -突触核蛋白的小鼠中,叶的团队发现多巴胺的代谢物DOPAL也增强了观察到的α -突触核蛋白和TrkB之间的相互作用。DOPAL被认为能促进α -突触核蛋白的聚集。然而,抑制DOPAL生成的药物rasagiline会干扰α -突触核蛋白/TrkB的相互作用。