突破性癌症治疗带来希望和挑战
食品药物管理局(Food Drug Administration)于8月份批准的第一种癌症基因疗法将改变儿童和年轻人中一种特定类型的癌症的治疗。它具有变革性,因为它使用患者自己的免疫细胞来攻击癌细胞。希望这只是能够利用患者免疫系统的许多其他药物中的第一个。
但是,这个治疗,被称为Kymriah(Tisagenlecleucel),并且在管道中的类似挑战为决策者带来了困难的挑战。第一作者卡伦·马奇克(Karen Maschke)说:“安全,访问和成本 - 如果每个人都将受益,必须弄清楚所有这些。”
Maschke,Michael Gusmano和Hastings中心总裁Mildred Solomon描述了突破,评估挑战,并在十月号发行的建议中提出建议卫生事务。
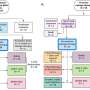
新疗法是由诺华开发的,用于治疗儿童和年轻人带有复发或难治性B细胞前体急性淋巴细胞白血病(全部)。称为嵌合抗原受体(CAR)T细胞治疗,它通过基因重新设计患者的t来起作用细胞,,,,白血细胞在免疫系统中。然后将改变的T细胞注入患者中,以攻击癌细胞。
安全
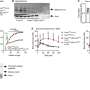
诺华进行的临床试验发现,在接受一次输注三个月后,有63名患者中有52例处于缓解状态。但是,该疗法还具有76%的患者的神经系统危及生命的神经系统和其他副作用,并增加了患者患者患者的风险。
作者指出,随着汽车T细胞癌的治疗继续进行临床试验在获得FDA批准之前,“ FDA和机构审查委员会(IRB)对人类受试者的监督研究必须仔细仔细审查[风险福利概况],以确定研究治疗的潜在益处是否证明允许癌症患者参加一项研究。“
他们还建议IRB确保所有同意书清楚地陈述了不良影响的可能性,并且FDA对患者遇到的不良事件进行许可后监控。该机构要求诺华对Kymriah的安全性和有效性进行后排化研究。他们写道:“但是,在唐纳德·特朗普(Donald Trump)总统的管理下,FDA是否会从突破性治疗产品中撤回许可批准,这是一个悬而未决的问题。
使用权
作者引起了人们的担忧,即许多可以从治疗中受益的患者将无法获得它 - 至少一段时间没有。那是因为对患者的T细胞进行基因重新设计,进行输注并治疗严重的副作用所需的高度专业技能是短暂的。Kymriah将在仅16个州的认证治疗中心提供,仅四个,只有一个治疗地点。“拥有训练有素的临床人员的站点更少,治疗非常病患者他们写道:“通常是确保高质量交付复杂治疗方法的最佳选择,但至少起初将面临严重的挑战。”
成本
文章解释说:“即使可以解决有限的可用性问题,待遇的成本仍然引发了重要的司法问题。”一次性输液的Kymriah将花费475,000美元,而FDA批准疗法并不能保证保险公司会覆盖它。
作者写道:“如果汽车T细胞疗法与最近的突破性治疗一样安全有效,那么好处将是巨大的,需求将很高。”“但是,与其他最近有益但高价药物一样,CAR T细胞疗法可能会导致更高的医疗保健成本,高度有限的访问权限,甚至更大的访问和健康成果。没有破坏美国人的医疗保健系统或袖珍书,道德和明智的政策的治疗,需要赶上科学。”
进一步探索