更接近对阿尔茨海默病的治疗更近一步?
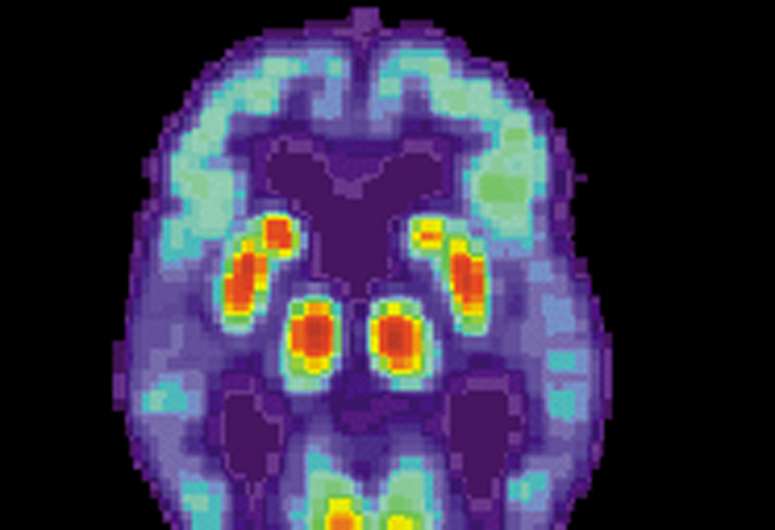
Massachusetts综合医院(MGH)的科学家与加州大学圣地亚哥(UCSD)合作,为阿尔茨海默病的潜在治疗组织了一类新的毒品,并在他们将如何工作的难题中发现了一块。他们的研究,使用疾病相关的动物和细胞模型,表明用这种γ-分泌酶调节剂的代表性化合物治疗导致阿尔茨米默蛋白相关的β-淀粉样蛋白的减少。该研究已在线发布EBioMedicine,由Cell Press和刺血针联合发布的开放式期刊。
“我们的研究探索γ分泌酶的机制调节器减少β-淀粉样蛋白水平42岁的阿尔茨海默病的主要病理司机,”张可以(Martin)说,医学博士,博士,遗传学和衰老研究中心的大众婴幼儿专科研究所神经退行性疾病(MGH-MIND)共同通讯作者EBioMedicine纸。“这些发现将有助于开发可能有效治疗和预防阿尔茨海默病的分子。”
最常见的神经变性障碍,阿尔茨海默病的疾病的特点是堆积淀粉样斑块神经纤维缠结在大脑的几个区域。其发病机制的主要假设是淀粉样蛋白级联,这表明淀粉样蛋白β -蛋白,特别是淀粉样蛋白β - 42肽,引发了疾病的进程。淀粉样蛋白的产生和清除之间的不平衡导致蛋白质聚集成更大的斑块,导致脑细胞的死亡和老年痴呆症患者的认知症状。一些潜在的治疗方法已经被开发出来专门针对淀粉样蛋白,但没有一种是有效的阻止疾病进展。
淀粉样蛋白β由较大的裂解产生淀粉样前体蛋白(APP)由叫γ-分泌酶的酶。以前的研究导致了γ-分泌酶抑制剂的发展,完全阻断酶的功能,但在临床试验中,这些药物通过它们对其他蛋白质的处理产生严重的副作用。
鲁道夫Tanzi博士MGH遗传学和衰老研究中心的主任和史蒂文·瓦格纳博士USCD部门的神经科学——共同通讯作者,当前的研究首次开发γ分泌酶调节器(gsm)的概念,改变,但是不完全抑制酶的活动,早在2000年。最近,他们的团队开发了一组可溶性gsm,其中一种——SGSM-36——似乎是临床开发的一个有希望的候选药物。
在目前的研究中,研究人员表明,在遗传的阿尔茨海默氏植物的验证小鼠模型的大脑模型中,SGSM-36的淀粉样蛋白β22水平降低了三天的治疗,而不是影响其他酶的处理。在蜂窝模型中 - 包括三维“盘子里的老年痴呆症”由Tanzi的团队开发的系统 - 将SGSM-36的动作与Semagacestat的作用进行了比较,临床试验失败的γ-分泌酶抑制剂之一。虽然Sgsm-36处理仅减少了有毒淀粉样蛋白β40和42肽的水平,但Semagacestat还原了所有形式的淀粉样蛋白以及其他蛋白质的γ分泌酶加工,包括重要的信号蛋白缺口,减少可能导致的γ-分泌酶抑制剂治疗的毒性作用。
为了更好地理解SGSM-36如何改变γ-分泌酶及其功能。该团队使用荧光寿命成像显微镜检查分子,识别SGSM-36扩大蛋白质的三个特征环之间的空间的位点,赋予了更开放的构象,这已被证明与降低毒性形式的产生相关联淀粉样蛋白β。
“基因、生化、分子生物学和病理证据都支持这样的假设,即-淀粉样蛋白——特别是-淀粉样蛋白42——的过度积累是导致阿尔茨海默氏症相关病理的主要原因,”张教授说,他是哈佛医学院(HMS)神经病学助理教授。“在我们未来的研究中,我们将测试SGSM-36与类似的分子,这些分子可能具有同等或更高的降低淀粉样蛋白- 42的能力,并进一步研究其在动物模型中的分子机制,最终的目标是测试它的潜力临床试验。"
进一步探索











用户评论