对细胞毒性淀粉样蛋白原纤维的更强烈扭曲
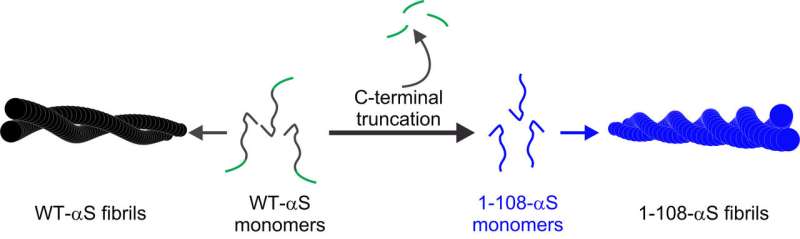
来自阿姆斯特丹和Enschede的研究人员首次进行了两种与帕金森病相关的淀粉样蛋白原纤维的结构比较。使用实验方法的组合,他们表明,体内丰富的α-突触核蛋白蛋白的细胞毒性C-末端截短形式聚集成更强烈的扭曲的原纤维,其更暴露于水中。结果已发表于此美国化学学会杂志。
这项研究是由博士生Steven roters(阿姆斯特丹大学范特霍夫分子科学研究所,由Sander Woutersen教授指导)和Aditya Iyer (AMOLF,由阿姆斯特丹自由大学Vinod Subramaniam教授指导)进行的,与特文特大学的Vladimir Kogan和Mireille Claessens教授合作。
使用各种技术的组合,其中原子力显微镜,紫外线二分,X射线衍射和二维红外光谱,研究人员进行了结构分析,以解释野生型α -synuclein (WT-αS)聚集和c端缺失32个氨基酸的所谓的c端截断形式(1-108-αS)的差异。后者最近被其他组观察到在体内相当普遍。它形成聚集更快,并与帕金森病的进展形式有关。
研究人员得出的结论是,由1-108-α s形成的纤维扭曲更强,而且——可能由于更强的扭曲——它们的纤维核心更暴露于水。纤维内的氢键蛋白薄片之间的距离似乎更大。1-108-αS和WT-αS原纤维之间的这些差异甚至如此明显,WT-αS单体不能生长为1-108-αS原纤维的短片段。
通过阐明两种纤维状物种的关键结构方面,尤其是更具细胞毒性1-108-αs原纤维,研究人员希望提供有助于理解帕金森和其他相关淀粉样蛋白疾病的分子机制的线索。
进一步探索











用户评论