阿尔茨海默氏症τ蛋白形成有毒和细胞膜复合体
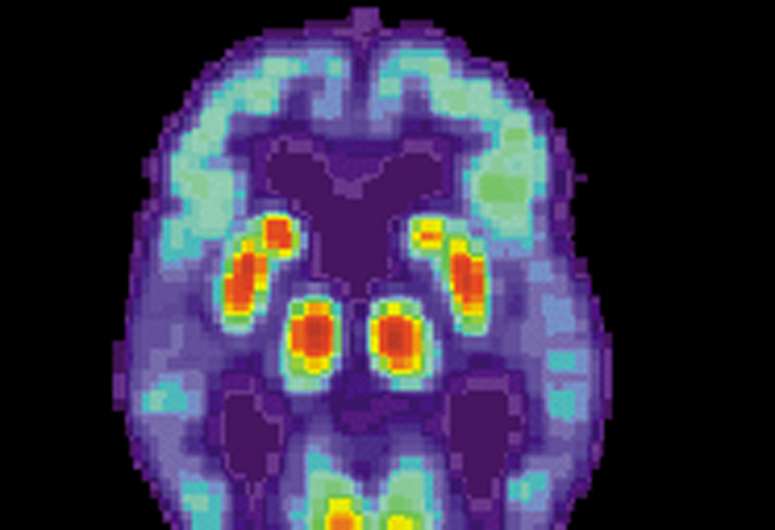
老年痴呆症患者的大脑神经元缠结内含有特征。这些缠结时形成一种叫做τ的蛋白质聚集成扭曲的纤维。因此,神经元的运输系统瓦解,必需营养素不能穿过,细胞开始死亡,影响大脑的功能和导致这种疾病的症状。
鉴于其在阿尔茨海默病的病理作用,τ蛋白质已经进行了广泛的调查。最近和几个amyloid-targeting治疗的临床试验失败,τ已经成为最活跃的追求治疗阿尔茨海默病的目标。然而,问题仍然是如何τ利差在大脑和神经元死亡。细胞膜被证明能扮演一个角色在调节τ的聚合性质和生理功能,但我们仍然不明白τ和脂质膜之间的相互作用会导致神经元的损失出现在阿尔茨海默氏症。
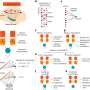
希拉尔的实验室Lashuel EPFL,合作实验室的托马斯•洛克菲勒大学Walz发现个别Tau蛋白质相互作用和破坏神经元的细胞膜。这一中断产生高度稳定的复合物组成几个Tau蛋白质以及脂肪分子(磷脂)膜。
随后的研究表明,蛋白质/磷脂复合物相比更容易被神经元原纤维形成的蛋白质,和诱导海马的主要神经元体外毒性。海马体是内存处理和损失海马神经元是一个典型的阿尔茨海默氏症的症状。配合物被检测到的抗体(MC-1)作为标准检测病理τ的构象,这意味着他们分享一些特性的病态形式的蛋白质。
“我们的目标是识别序列和结构性因素驱动τ与膜,这些复合物的形成,这样我们可以开发策略来干扰他们的形成和阻止其毒性,“说Nadine Bouziad,领导这项研究的博士生。
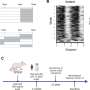
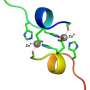
与大卫以利以谢教授合作在纽约威尔康奈尔医学科学学院,研究人员利用核磁共振(NMR)来洞察τ的核心复合体的结构。这表明的核心是由两个小肽,每个只有6个氨基酸长。这些肽称为PHF6 * PHF6,他们扮演了一个重要的角色在推动τ聚合和组装成纤维。他们的存在连接蛋白/磷脂复合物与阿尔茨海默氏病的发展。
在他们的研究成果的基础上,研究人员能够产生变异Tau蛋白质。引入突变破坏了τ与细胞膜相互作用的能力,但并没有干扰的能力形成原纤维。这背后的想法是,这种突变体可用于这两个过程分开,可以让研究人员调查,这些膜的相互作用对函数的影响,聚合和τ的毒性主要神经元的文化。这将是一个第一步获得一个清晰的τ缠结开始形成,这将是至关重要的,如果我们要发展有效的疗法,以抵消他们的毒性。
“我们的研究结果指向一种小说的τ蛋白/磷脂复合物的一部分膜端依赖机制调节τ结构、寡聚化毒性,可能其之间的正常和异常交易和内部神经元,”希拉Lashuel说。“通过开发工具,允许我们探测、破坏和/或目标这些复合体,我们希望确定新策略来抑制τ聚合,毒性,并在阿尔茨海默氏症的大脑病理学蔓延。”
更多信息:Nadine Ait-Bouziad et al,发现和描述稳定和有毒τ/磷脂低聚物的复合物,自然通讯(2017)。DOI: 10.1038 / s41467 - 017 - 01575 - 4