众所周知的蛋白质的秘密改变自我对抗渗漏的血管
每一次心跳,就有1。5加仑的血液在身体的静脉和动脉网络中跳动。这种血液流动的力量有助于保持血管内皮细胞的健康;当血流中断时,比如在外科手术或中风时,血管就会开始渗漏,这会引起一系列炎症反应,导致细胞损伤和疾病。哈佛大学(Harvard University)怀斯研究所(Wyss Institute)的科学家们着手解决血液流动如何使血管保持完整的谜团,令他们惊讶的是,他们发现了一种全新的细胞信号通路,这是治疗各种疾病的药物很有希望的靶点。
“我们发现著名的Notch蛋白负责保存血管成为漏水的,并通过二次信号通路,在一个完全不同的方式比已知transcription-based通路,”克里斯说,医学博士,博士,副Wyss学院的教员和波士顿大学生物医学工程教授,论文的通讯作者。“这个新途径不仅从发现的角度来看令人兴奋,它还可以减轻癌症和心血管药物的一些副作用,使它们更安全、更有效。”这项研究今天发表在自然。
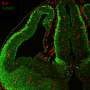
这内皮细胞这条线血液船只通过称为粘附结的连接紧密地连接在一起,形成一条阻挡血液内部的屏障船调节其他物质进出的容易程度。为了研究这一屏障,并确定为什么缺乏血液流动会导致它泄漏,研究人员建立了一个芯片上的血管模型,该模型由内衬一层血管层的通道组成人类内皮细胞通过微流体装置内的细胞外基质包围,其允许它们通过血管轻松模拟和控制血液流动并评估细胞的反应。
经历了血流的内皮细胞显示出跨膜蛋白Notch1的活性增加,而暴露于静态血液中的细胞则没有。当研究人员添加了一种阻止Notch1激活的化学物质后,他们观察到血管开始渗漏,他们认为这是由于邻近内皮细胞之间的粘附连接被破坏,以及每个细胞内肌动蛋白纤维的重组造成的。证实了血流激活Notch1对于血管内皮屏障的形成和维持是必要的。
奇怪的是,阻断Notch1的已知作用机制——它的胞内区域与蛋白质的其他部分分离——并没有使血管泄漏,这意味着蛋白质的其他部分正在对其产生反应血液流动。在体内实验中,科学家们给老鼠注射了一种化学物质,这种化学物质可以和蓝色染料一起阻断Notch1的激活,结果发现这种染料从老鼠血管中渗出的速度比预期的要快得多。“将一个基因转录到一种蛋白质中,然后在细胞内执行一些功能,通常需要大约两个小时,但我们在阻断Notch1后的30分钟内看到了泄漏,进一步表明,无论什么过程控制着屏障的渗透性,都是通过一种完全不同的机制运作的,”比尔·波拉切克博士说,他是维斯研究所的博士后研究员,也是这篇论文的共同第一作者。
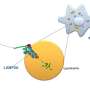
一旦他们确定细胞内结构域未参与调节内皮屏障,科学家们扫描了Notch1的其他部分以进行活动。它们使用CRISPR / CAS-9删除Notch1基因的各个部分,发现删除了细胞内结构域的代码对渗透性影响的部分,同时删除了用于微型跨膜结构域(TMD)的代码的部分引起的血管在流动条件下泄漏增加。“这是第一次曾经评估了缺口TMD的生物学功能,”Wyss Institute和Co-First Author的访问研究员,Ph.D。“在激活后,它在很大程度上被认为是惰性的,并且在激活后,大多数教科书和研究论文甚至没有将其作为陷波受体的独特部分。”通过进一步的测试,他们认为当Notch1被激活并且其细胞内结构域被释放时,其TMD将膜中的复合物与蛋白质Ve-Cadherin,RAC1,Lar和三重组组合,它们共同组装和维持粘附的连接之间细胞在细胞膜上分布肌动蛋白纤维来支持这些连接。
“回想起来,我们在这个项目上孤注一掷,因为通过选择调查Notch,我们进入了生物学中最拥挤的研究领域之一。但我们基于工程的方法让我们以一种新的方式研究它,没有过去工作的影响或偏见,我认为这是使我们足够开放,观察和描述这一新的,意想不到的途径,”Polacheck说。Kutys补充说:“除了细胞分化之外,Notch1[通过新的tmd控制途径]调节细胞粘附[通过先前描述的转录途径],这也为理解复杂细胞过程的协调提供了一个新的框架,因为像Notch这样的单一分子可以发挥多种作用。”
Notch1的启示提供不同的功能,并且知道蛋白质的哪些部位治理每个功能,允许开发新的药物,这些药物既比更有效和更低的毒性。“缺口是一些癌症疗法的目标,但已知这些药物会导致水肿[体内的流体收集]和其他问题。现在,我们积极努力分离陷波的两个途径,以便我们可以创造毒品目标是细胞内结构域耶鲁大学医学院医学和遗传学教授Karen Hirschi博士说,他参与了这项研究。Notch控制着血管通透性,这使得它成为治疗心血管疾病新药的候选药物,该团队也在研究TMD作为一种潜在的治疗药物本身,因为暴露于渗漏诱导炎症的细胞模型在被设计表达TMD时,渗漏明显减少。
进一步探索








用户评论