女性和少数族裔充分代表在新药物测试?

一项新的研究来评估的影响美国食品和药物管理局(FDA)规定和指导,旨在鼓励更多的女性和少数族裔在临床药物试验,表明适当水平的女性参与基于人们的性别比例估计受特定的疾病。相比之下,一些种族少数民族,特别是非洲裔美国人,仍未在大多数药物开发项目,根据这项研究发表在女性健康杂志》上。
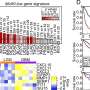
Emmanuel Fadiran博士和他的同事们从药物评价和研究中心(CDER),和女性健康的办公室,办公室专员的FDA检查临床试验参与者的人口构成和疗效和安全性数据是否获得了男性和女性之间的新药批准由CDER 2013 - 2015。评估性表现在药物有效性和安全性测试,研究人员确定的比例比女性人口为特定的疾病在临床试验中相对于估计的女性疾病的人口比例(PPR)新药的迹象。
作者报道,性分析的有效性和安全性进行了对于大多数新药应用在研究期间。此外,女性的代表临床试验适合更多的新药当估计患病率按性别(PPR)被认为是。这些研究结果本文提出了名为“代表女性和少数族裔在临床试验新分子实体和原始生物疗法FDA批准CDER从2013年到2015年”。
“结果Fadiran等人提出的帮助让我们放心女性被包含在一个适当的水平在所有阶段的临床药物研究。然而,这将是重要的未来保持警惕潜在的性差异在新药开发中,和一些应对持续的话语权缺失少数种族,尤其当他们可能有一个相对较高的患病率为特定药物指示”,主编苏珊·g·Kornstein博士说女性健康杂志》上弗吉尼亚联邦大学研究所的执行主任对于女性健康,里士满,弗吉尼亚州,总统的女性健康学院。
进一步探索