组合策略可以持有卵巢癌的承诺
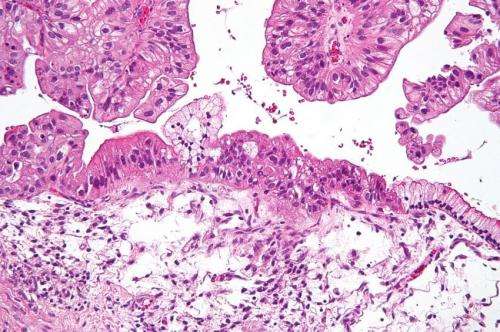
Johns Hopkins Kimmel Cancer Center的研究人员展示了卵巢癌的小鼠接受了可重新激活休眠基因的药物以及激活免疫系统的其他药物的肿瘤负担减少,并比仅接受任何药物的存活率明显更长。
这项研究已经刺激了临床试验卵巢癌病人。由研究生梅雷迪思·斯通博士领导的调查人员;博士后研究员Kate Chiappinelli博士;资深作家辛西娅·扎诺博士认为,这可能会导致一种攻击卵巢的新方法癌症通过加强身体的自然免疫反应对抗这些肿瘤。它发表于2017年12月4日,问题国家科学院的诉讼程序。
在美国,卵巢癌是目前导致妇科恶性肿瘤死亡的主要原因“我们采用了两种对卵巢癌不太有效的疗法,并将它们组合在一起,使它们能更好地加速免疫系统和攻击卵巢癌肿瘤Zahnow说,他是约翰霍普金斯金梅尔癌症中心的肿瘤学副教授。
Zahnow说,一类称为检查点抑制剂的免疫疗法药物目前正在彭博〜Kimmel癌症免疫疗法研究所,有助于免疫系统识别癌症并将它们击败。该药在治疗黑素瘤,非球体细胞肺癌和肾细胞癌症方面取得了成功,但它们对卵巢癌仅适度影响。
同样,已知另一种称为表观遗传疗法的药物通过转动已经通过化学标签的存在而被沉默的基因来治疗某些类型的癌症,或者通过称为甲基,或通过缠绕在蛋白质线轴周围的蛋白质轴上,被称为组蛋白 - 但这些药物也没有对卵巢癌有效。
Zahnow和她的同事强烈调查通过他们的群体中最近的两种出版物治疗卵巢癌的新途径,这些出版物显示表观遗传药物在卵巢,乳房和乳腺癌中的免疫信号传导结肠癌细胞(李等人,Oncotarget2014)。当表观遗传疗法激活古逆转录病毒片段时,这些免疫基因被激活,这些片段激活细胞中1型干扰素信号(Chiappinelli等人,细胞2015)。Stone, Chiappinelli和Zahnow想知道这种免疫信号的增加是否会导致肿瘤杀伤的增加免疫细胞癌症。
Zahnow和她的同事们研究了这种疾病的小鼠模型,将小鼠卵巢癌细胞注射到动物的腹部以模拟人类疾病。这些细胞最终发展成数百个小肿瘤,导致液体在腹部聚集,即所谓的腹水。漂浮在这种液体中的是癌细胞和免疫细胞的环境,提供了一种方便的方法来监视肿瘤和动物的免疫反应。
研究人员开始预处理卵巢癌细胞在用DNA甲基转移酶抑制剂的培养皿中的动物外面(a药品从DNA中敲除甲基)称为5-氮杂胞苷(AZA)。在将这些细胞注射到小鼠体内后,研究人员发现,与注射了这些细胞的小鼠相比,接受预处理细胞的小鼠腹水或肿瘤负担显著减少,腹水中的抗癌免疫细胞显著增多未经处理的细胞。这些细胞在与免疫应答有关的各种基因中也增加了活性。用组蛋白脱乙酰酶抑制剂(HDACIS)预处理这些细胞,其有助于从组蛋白中解除DNA,并没有影响动物的腹水或促进其免疫应答。
这些早期发现表明,AZA诱导的基因活性变化导致肿瘤细胞自身召唤免疫细胞到它们的位置。此外,当研究人员将未经处理的细胞移植到小鼠体内,并同时用AZA和HDACi治疗小鼠时,腹水中的免疫细胞显著增多,这表明HDACi对小鼠的免疫系统起作用。与只接受AZA治疗的小鼠相比,这些小鼠的腹水减少,肿瘤负荷降低,生存期延长。
当研究人员同时用AZA和HDACi以及免疫抑制剂检查站,他们得到了最大的反应 - 腹水和肿瘤负担的最高减少,最长的存活率。使用免疫环化小鼠的进一步实验表明,免疫系统对这些药物的作用至关重要,而不是药物本身直接作用于杀人肿瘤细胞。
“我们认为AZA和HDACis带来了士兵,或免疫细胞,战斗。但检查点抑制剂正在向他们提供武器,“Zahnow说,他还与Epigenetics Scientics Stephen Baylin,M.D.,M.D.。
通过该研究产生的临床前数据已经用于通过正在进行的临床试验来帮助卵巢癌患者来测试组合AZA和检查点抑制剂的有效性。未来的试验可以添加HDACI以确定它是否会影响结果。
“结合表观遗传疗法和检查站阻挡者导致最大的减少肿瘤负担Zahnow说,Zahnow说,增加了我们小鼠模型中生存的生存,并可能对我们的患者持有最大的承诺。
进一步探索











用户评论