新发现的防止胶质母细胞瘤的机制
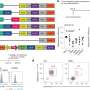
西班牙国家癌症研究中心(CNIO)的一组研究人员发现了一种名为RanBP6的蛋白质,它是EGFR的一种新的调节因子。在一篇发表于自然通讯他们表明沉默RanBP6是如何通过上调EGFR表达来促进胶质瘤生长的。此外,在小鼠异种移植模型中,RanBP6的重建导致肿瘤生长减少。作者指出,这些发现可能具有重要的临床意义。
恶性脑瘤约占已知癌症的3%,全球每年约有10万例新确诊病例。胶质母细胞瘤是成人最常见和最致命的原发性中枢神经系统肿瘤。十年的研究强调了胶质瘤基因组的复杂性,但绝大多数基因改变的功能意义仍然难以捉摸。
由Massimo Squatrito领导的研究小组与纽约纪念斯隆-凯特琳癌症中心(MSKCC)的Ingo Mellinghoff实验室合作,现在发现了一种有助于防止胶质母细胞瘤发展的新机制。
表皮生长因子受体(EGFR)在正常发育和人类癌症中起着至关重要的作用。EGFR是第一批受体酪氨酸激酶与人类癌症相关,是肿瘤学中重要的药物靶点。癌症中EGFR的异常激活刺激肿瘤生长,主要归因于基因拷贝数增加或功能获得性突变。然而,它也可能是由于EGFR反馈调节缺陷造成的。
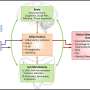
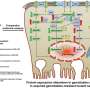
这项研究的共同主要作者Barbara Oldrini和Wan-Ying Hsieh发现了EGFR调控的一个新的复杂层面。Oldrini和同事们发现了一种以前未被鉴定的蛋白质ranbp6,它是EGFR表达的调节剂。作者表明RanBP6调节STAT3的核输入。RanBP6沉默损害STAT3核易位,导致EGFR转录抑制和EGFR通路输出增加。
“我们的研究首次表明STAT3是EGFR表达的直接抑制剂。我相信这具有重要的临床意义:STAT3抑制剂目前正在研究用于胶质母细胞瘤和其他肿瘤类型的治疗。抑制STAT3信号可能会导致EGFR信号的意外激活,”Massimo Squatrito说。
在部分胶质母细胞瘤患者中发现了RanBP6位点的局灶性缺失,RanBP6的沉默通过上调EGFR表达促进了胶质瘤小鼠模型中胶质瘤的生长。此外,在缺乏RanBP6表达的人胶质瘤细胞系中,RanBP6的重建导致异种移植小鼠模型中肿瘤生长的减少。
“我们的研究结果提供了一个例子,通过沉默核输入途径的组成部分,EGFR在癌症中的监管放松。我们已经确定了Ran-GTPase核转运途径和关键癌症信号通路之间的新联系,随着靶向核转运蛋白的抑制剂进入临床评估,这一联系值得进一步研究癌症芭芭拉·奥尔德里尼说。