科学家们解开了mTOR的结构,这是一种关键的癌细胞信号蛋白
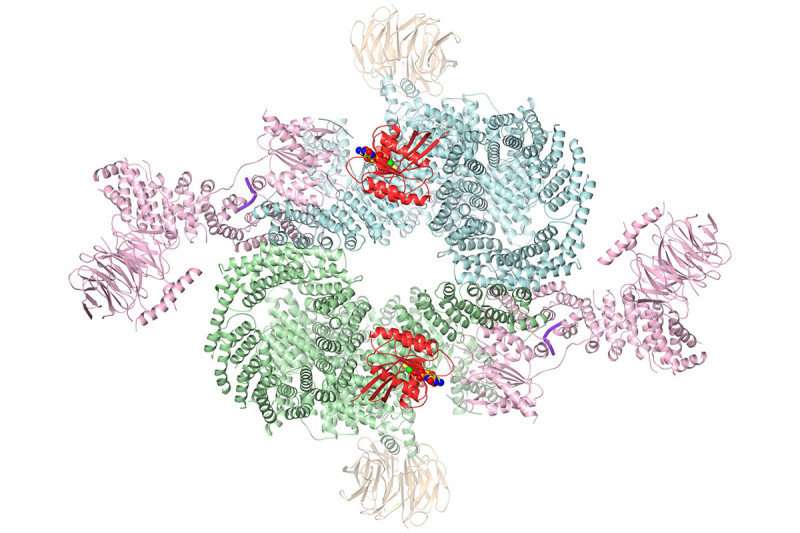
斯隆凯特林研究所的研究人员已经解决了癌细胞中一种重要信号分子的结构。他们使用了一种叫做低温电子显微镜的新技术来可视化三维结构。该图像提供的详细信息为药物的合理设计奠定了基础。
科学家称其为主要生长调节剂:细胞中的一种蛋白质复合物,它能感知到细胞何时有足够的营养物质来生长和分裂。
当该复合体称为MTOR被触发时,细胞开始制作关键成分的副本,例如膜,DNA和细胞器。当他们分成女儿细胞时,他们将需要这些额外的材料来消除。
癌细胞也需要mTOR。事实上,许多癌症已经找到了保持mTOR蛋白活性的方法。这是它们确保细胞无限分裂的方法之一。
多年来,科学家们试图将异常活跃的MTOR与药物视为一种治疗方式癌症。有两种药物获得了FDA的批准,用于治疗某些类型的肾癌和乳腺癌。
但总的来说,MTOR靶向药物一直在令人失望。这可能是因为MTOR是一块大而复杂的蜂窝设备。有许多互动部件,可能很难用一次射击击倒整个东西。
现在,由结构生物学家尼古拉·帕夫莱蒂奇领导的斯隆·凯特林研究所(SKI)的一组科学家已经收集了一幅令人印象深刻的细节图蛋白质复合体,包括它在行动中的样子。这张超高分辨率的图像可以帮助我们设计出更有效的药物来阻断这种关键的癌症诱因。
冰冻帧:Cryo-EM捕获mTOR的完整图片
这幅新图片是一种叫做低温电子显微镜(cryo-EM)的尖端研究工具的产物。该工具为其研发者赢得了今年的诺贝尔化学奖。该工具将电子束射向在液氮中快速冻结的蛋白质。电子以精确的方式从样品反弹,形成图像。这个过程和照相机的工作方式没有太大的不同:光线从物体反射到你的照相机镜头,产生一个摄影图像。利用低温电子显微镜,成千上万的这样的照片被拍摄下来,然后电脑将它们重新组合成精确的三维图像。
在此之前,这种详细的原子对原子的图像只能用x射线晶体学来制作,这是一种艰苦而耗时的方法,首先需要从蛋白质中制造出晶体。但并不是所有的蛋白质都会形成晶体。对于大型蛋白质和具有多个运动部分的蛋白质复合物(比如mTOR)来说尤其如此。
低温电子显微镜消除了结晶步骤。这使得使用该技术确定结构更加容易和快速。
“在2008年,我们实际上有几十毫克这种蛋白质,但我们不能确定全部的情况,”SKI帕夫莱蒂克实验室的高级研究科学家杨海娟(Haijuan Yang)说,她是一篇新论文的第一作者自然。
因此,她和她的同事们开始截断蛋白质,切掉一部分直到有一部分结晶。他们在2013年发表了关于这一较小碎片的发现。
与许多蛋白质一样,MTOR是一种酶,其以精确的方式与靶分子结合以加速化学反应。具体地,它是一种激酶,其从ATP,细胞的能量货币中除去磷酸盐(P),并将它们放在其他分子上。从2013年的研究中占据了五年多年来,该团队学会了一些关于蛋白质的关键问题,例如ATP结合位点看起来像什么,其中一种称为雷帕霉素的药物结合。
但这仍然只是片面的看法。mTOR蛋白实际上是由几个联锁蛋白组成的更大的集合的一部分蛋白质亚基一起运作。整个综合体称为mTORC1。除了结合ATP的亚基之外,还有一个叫做RAPTOR的亚基,它作为信号链的一部分与其他蛋白质相互作用。mTOR酶被一种叫做RHEB的蛋白质激活,被一种叫做PRAS40的蛋白质抑制。
通过低温电子显微镜新获得的结构显示了所有这些片段是如何组合在一起的,包括mTOR酶是如何被激活的。
杨博士说:“我们发现RHEB导致了复合物的主要构象变化。”RHEB结合创造了一个没有这种结合就不存在的新界面,然后扭曲mTOR激酶结构域,将其带入活性构象。”
最后,他们展示了这种蛋白质中常见的癌症相关突变是如何有效地使其永久处于活性状态的。
一长串癌症相关结构的最新进展
解决mTORC1的结构只是帕夫莱蒂奇博士和他的实验室成员解决的一长串蛋白质结构中的最新一个。在20世纪90年代,他们破译了p53的结构,这是癌症中最常见的突变蛋白质。在21世纪初,他们确定了结构体BRCA2是一种参与DNA修复的肿瘤抑制蛋白。当发生突变时,这种蛋白质与乳腺癌、卵巢癌和前列腺癌的遗传易感性有关。
杨医生说,他们计划重新研究BRCA2蛋白。用低温电子显微镜研究它将使他们获得比以前更多的信息。
“以前,人们可以模拟这种蛋白质和那种蛋白质的片段蛋白质,”她说。“现在,有了低温电子显微镜,我们就可以把这些信息整合到一起。”
进一步探索













用户评论