普通帕金森突变后的机制发现
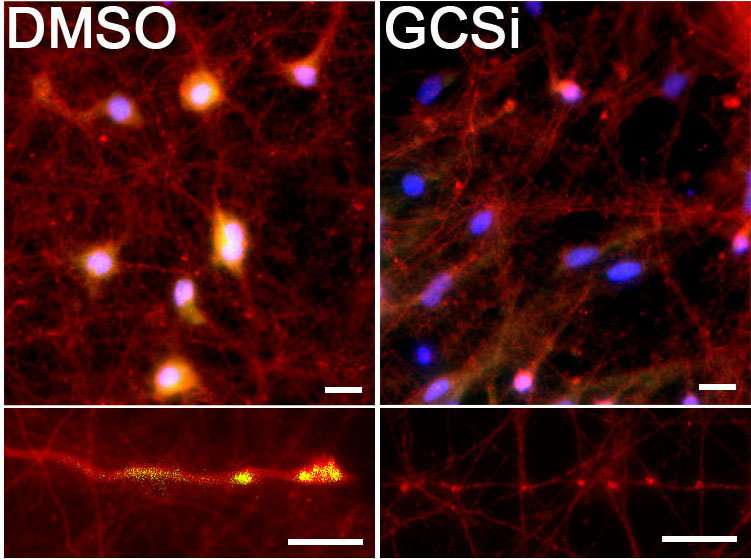
美国西北医学院的研究人员发现了一种基因突变是如何导致一种导致帕金森病症状的有毒化合物积累的,并首次定义了这种疾病的潜在机制。
该研究发表于神经元根据高级作者Joseph Mazzulli,Ph.D.,Ken&Ruth Davee神经疾病,Ph.D.的助理教授,指向潜在的新药治疗潜在的新型治疗途径Gaucher疾病的潜在新的治疗途径。
在帕金森氏症中,一种名为α -synuclein的蛋白质在中枢神经系统中被转化为不可溶的有毒簇——但确切的转化机制直到现在才为人所知。
用于开发这些簇的最强大的危险因素之一是基因GBA1中的突变,其通常降解称为葡萄糖胺的脂质。基因中一种突变的患者遭受血糖氧酰胺水平增加,已被证明具有5倍的帕金森的风险。患有来自每个父母的两个突变形式的基因形式,可以发展Gaucher的疾病溶酶体储存障碍。
Mazzulli和他的同事利用这种基因联系来阐明gba1影响帕金森病的机制。利用神经元的干细胞模型,他们使用了一种药理学抑制剂,在没有GBA1基因突变的情况下提高糖基神经酰胺的水平。即使没有突变,这也导致了有毒的α -突触核蛋白在神经元中的大量积累。
“这提出了我们向我们将α-突触核蛋白从其正常形式转化为其致病形式的关键因素不一定存在突变的GBA1蛋白质,但更重要的是葡萄糖胺的活性和积累的存在性,”Mazzulli说。
通过考虑到这一认识,研究人员仔细研究转换过程,发现α-突触核蛋蛋白的健康形式以两种不同的形式存在,一种简单的分子和更复杂的分子。虽然以前认为只有简单的分子转化为有毒品种,但意外地发现宫殿和他的同事发现复杂的分子被葡萄糖酰胺直接转化为有毒的α-突触核蛋白。
Mazzulli说:“我们惊讶地发现,毒性聚集是通过大型α -synuclein复合物的直接转化发生的。”“我们认为,在形成有毒聚集体之前,复合物必须首先分解,但我们的数据并非如此。”
Mazzulli说,这些发现表明,靶向该途径的未来疗法可能利用最初用于治疗Gaucher病的药物。虽然制药业一直对使用那些脂还原剂有些时间有兴趣,但本研究定义了这些努力背后的分子过程,并展示了它如何工作。
“一些公司一直在使用合酶抑制剂来减少脂质的合成,我们在研究中也对病人来源的神经元使用了类似的化合物,”Mazzulli说。“我们能够证明,它能直接减少来自帕金森氏症患者的神经元中的毒性α -synuclein聚集。”
此外,该研究提供了未来的药物试验,以衡量成功的重要指标,迈阿德利说。
“我们的最终目标是减少α-突触核蛋白然而,从活着的病人的中枢神经系统测量阿尔法突触核蛋白的水平是复杂的,”Mazzulli说。“测量改变患者体内糖基神经酰胺的治疗效果要容易得多,因为脂质可以通过容易获取的液体(如血液或脑脊液)直接测量。”
根据Mazzulli的说法,朝向功能性治疗的下一步将从干细胞衍生的神经元毕业到动物模型。
Mazzulli说:“我们正在试图确定这种情况是否会发生在活体动物身上,以及我们是否可以使用与临床试验中测试的类似的化合物来逆转它。”“如果我们能在任何不可溶淀粉样蛋白形成之前进行干预,也许我们就能将其逆转到正常状态。”
进一步探索










用户评论