肥胖与转移性黑色素瘤患者的更长的生存期有关
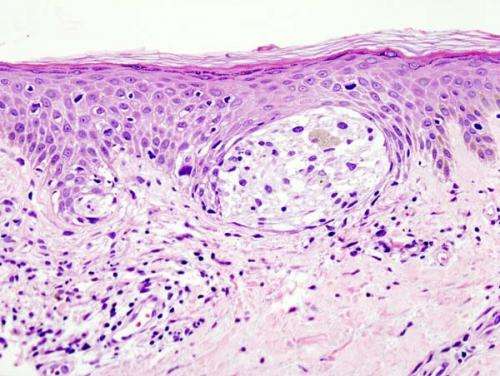
研究人员在一项研究中称,转移性黑色素瘤的肥胖患者接受靶向或免疫治疗后的寿命明显长于正常体重指数(BMI)的患者柳叶刀肿瘤学六个独立临床队列中的1,918名患者。
德克萨斯大学安德森癌症中心黑色素瘤医学肿瘤学讲师、第一作者Jennifer McQuade医学博士说,这种效应被称为“肥胖悖论”,主要表现在男性身上。
McQuade说:“肥胖男性的表现一直比BMI正常的男性好得多,总体生存率几乎是正常男性的两倍。”研究人员发现,BMI正常、超重和肥胖的女性在生存率上没有显著差异。
“问题是,是什么潜在机制导致了肥胖男性的这种优势,我们能利用它来改善黑色素瘤患者的预后吗?”McQuade说。“其中一个提示可能是肥胖、性和结果之间的相互作用,这是以前从未在任何癌症中发现过的。”
McQuade指出,女性转移性黑色素瘤患者的预后一直比男性好。在这项研究中,肥胖克服了男性的生存劣势,这使得研究人员现在开始研究性激素对这种影响的可能影响。
研究人员指出,这种联系并不能证明因果关系,但指出了需要更深入研究的新领域。
“公共卫生消息不是那种肥胖是好的。肥胖是许多疾病的证明危险因素,”麦克纳德说。“甚至在我们的内部转移性黑色素瘤人群,我们不建议病人故意增加体重。我们需要弄清楚是什么导致了这种悖论,并学习如何利用这些信息来造福我们所有的患者。”
据世界卫生组织称,肥胖是导致13种癌症的已知风险因素,并将取代吸烟成为可预防的癌症的首要原因。肥胖和癌症患者存活率之间的关系并不一致。最近的研究也显示了类似的生存益处肥胖病人用结肠直肠或肾癌。
肥胖预计是缺点
该团队希望发现肥胖对黑素瘤患者有害,部分研究表明肥胖会激活一种促癌分子通路,即IGF-1/PI3K/AKT。
他们分析了联合之间的关系身体质量指数(重量除以高度)和无进展的存活(PFS)和整体存活(PFS)和整体存活(OS)在六个独立的患者中,患有针对性治疗,免疫疗法或化疗的患者,导致这些药物的FDA批准。
在一项对整个组进行的整体meta分析中,PFS和OS的优势出现了,但与肥胖相关的生存获益仅限于接受靶向或免疫疗法的男性,其中肥胖男性与BMI正常男性相比,死亡风险降低了47%。
男性总生存率翻倍
599例接受达布非尼(BRAF抑制剂)和曲美替尼(MEK抑制剂)联合靶向治疗的患者的结果如下:
- 正常BMI为18.5-24.9,中位PFS为9.6个月,OS为19.8个月
- 肥胖BMI 30及以上,中位无生存期15.7个月,OS 33.0个月
一项包括年龄、性别、分期、疾病负担、某些突变和既往治疗等因素的多变量分析显示,与正常BMI患者相比,肥胖仍能改善PFS和OS。
研究小组按性别分析了结果,发现只有男性之间存在显著差异。
- BMI正常男性-无生存期7.2个月,OS 16.0个月
- 肥胖男性-无生存期12.8个月,生存期36.5个月。
相比之下,以女性为例,无论体重指数如何,总体中位生存率至少为33个月。
一项由240名接受vemurafenib (BRAF抑制剂)和cobimetinib (MEK抑制剂)治疗的患者组成的验证队列获得了类似的结果。
对于免疫治疗,在一组(330名患者)使用检查点抑制剂阻断T细胞上的PD1检查点或其PD-L1配体的治疗中,结果再次显示女性之间没有差异,但是:
- BMI正常男性-无生存期2.7个月,生存期14.3个月
- 肥胖男士 - PFS 7.6个月,OS 26.9个月
雌激素可能连接
研究人员正在跟踪研究可能给肥胖男性患者带来优势的生物学因素。肥胖与炎症的增加有关,这可能会提高检查点封锁药物的有效性,释放对癌症的免疫反应。
观察到的差异的性别特异性指出了一种潜在的荷尔蒙中介。脂肪组织会产生一种叫做芳香化酶的酶它能将雄性激素转化为雌性激素。也许这种情况在肥胖的男人McQuade说,帮助他们清除一些跨越更大的生存障碍。研究人员正在与宾夕法尼亚大学的调查人员合作,发现已经发现对黑色素瘤的雌激素受体进行了良好的雌激素受体,使其易于免疫疗法。
MD安德森团队还在研究基因表达、突变和免疫图谱,以确定肥胖和非肥胖患者中黑色素瘤的潜在差异耐心开发临床前模型。
进一步探索









用户评论