错误的细胞膜“混合”与帕金森氏症有关
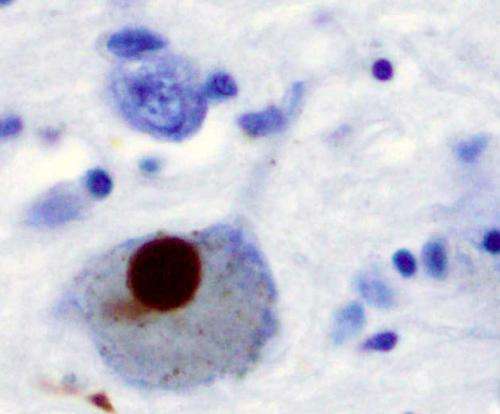
约翰·霍普金斯大学的研究人员报告说,他们利用实验室培养的人类脑细胞发现了帕金森病最常见的一种基因突变与大脑中脂肪斑块的形成之间的联系,这被认为会破坏帕金森病特征的运动神经元。
这种突变发生在含有GBA1(一种代谢酶)密码的基因上脂肪分子在构成大部分脑细胞细胞膜的细胞中。研究人员认为,脂肪分子混合物的变化导致蛋白质片段在大脑中粘在一起,在大脑中形成被称为路易体的“死区”,这会对运动、学习和行为产生负面影响。
这项研究的摘要发表在1月8日的《科学》杂志上美国国家科学院院刊。
约翰霍普金斯大学医学院细胞工程研究所神经学副教授Han Seok Ko博士说:“我们相信这项研究让我们更好地了解GBA1突变的影响及其在帕金森病的发展和进展中的作用。”
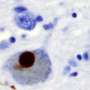
据Ko说,路易小体是由一种叫做α-synuclein的蛋白质团组成的。在健康的细胞在美国,单一的α-synuclein蛋白以四种蛋白质为一组,称为四聚体,这种蛋白质对在大脑中聚集更有抵抗力。然而,在帕金森氏症中,单个α-synucleins在细胞膜上粘在一起,使得神经元无法正常地相互沟通。
细胞膜就像一个马赛克,脂肪分子扮演着粘合剂的角色,以复杂的设计将蛋白质固定在细胞膜上。在健康细胞, GBA1确保“水泥”正确混合,以保持马赛克在一起。Ko说,他和他的团队推断,当GBA1发生突变时,这个过程就会出错,细胞膜的组成也会发生改变——这决定了α-synuclein四聚体是否能留在原位。
为了验证这一理论,Ko和他的团队使用基因编辑技术CRISPR-Cas9研究了去除实验室培养的人类神经元细胞中GBA1的效果。他们用一种主要用于阻止脂肪分子产生的药物——米格司他(miglustat)处理了一半“编辑”过的细胞,并观察了细胞中的蛋白质水平。
研究人员发现,删除GBA1会增加一种叫做糖基神经酰胺的特殊脂肪分子的水平。当糖基神经酰胺水平上升时,稳定的α-synuclein四聚体的数量下降。经米格司他治疗后,血药浓度几乎恢复正常。
Ko和他的团队认为,糖基神经酰胺水平的增加破坏了细胞膜混合物的稳定性,导致α-synuclein四聚体从镶嵌中脱落,分裂成单一的α-synuclein。
“这很有趣,因为过去的研究集中在GBA1突变如何导致单一α-synuclein聚集,而不是它对稳定的四聚体的影响,”Ko说。
然后,研究人员在从患有gba1相关帕金森病的患者身上收集的人类神经元中测试了他们的想法,发现与实验室培养的细胞一样,人类帕金森病细胞的细胞膜中葡萄糖神经酰胺的含量是没有发生帕金森病突变的细胞的两倍。同样,在这些细胞中,单个α-synuclein的数量也增加了,并且使用miglustat有效地将α-synuclein四聚体恢复到接近正常水平。
在最后的测试中,研究人员想要研究取代GBA1是否能恢复膜混合物的功能。在用病毒工程技术将GBA1基因的功能副本添加到细胞中后,Ko发现?-synuclein四聚体恢复到接近正常水平,α-synuclein聚集物的数量减少。
未来,研究人员打算进一步研究GBA1蛋白对α-synuclein四聚体形成和神经元整体健康的影响。
首次观测于2004年,GBA1-associated帕金森病是目前已知的帕金森病最常见的突变。研究人员称,5%到10%的帕金森氏症患者携带GBA1突变。
进一步探索












用户评论