分子那么多新的结核病药物可能是关键
结核感染大约四分之一的世界人口,每年造成近二百万人死亡,不仅是致命但古代:疾病的迹象被发现在埃及木乃伊。尽管其年龄、结核分枝杆菌、导致疾病的病原体,继续学习新技巧。它有一个特殊的进化抗生素耐药性的本领,使成千上万的人一些治疗方案。
现在,洛克菲勒科学家的指导下进行的研究Seth Darst,杰克·菲什曼教授,和伊丽莎白·坎贝尔,Darst高级研究助理的实验室,提供希望针对结核病的新和强有力的武器。出现在他们的工作eLife专注于一种抗生素,杀死结核分枝杆菌在实验室里,但是不适合临床使用。通过解释药物是如何工作的,他们的研究可能会让别人的设计新的抗生素实际上可以被用来治疗结核均甚至可能工作在其他错误。
一个有缺陷的候选人
坎贝尔解释说,抗生素的问题,fidaxomicin,极其善于杀死结核分枝杆菌在实验室里培养。对结核病是有用的在现实世界中,然而,一种抗生素必须被肠道吸收,最终达到肺部orally-something fidaxomicin不能服用。
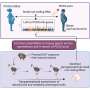
Fidaxomicin目标酶RNA聚合酶(RNAP), DNA转录成RNA,流程基本生活。酶具有铰链螯,或夹,波动获得DNA转录关闭。
科学家们怀疑这个夹药物是通过以某种方式干扰。但他们不知道如何对其业务知识分子就会创造更多有用的版本的fidaxomicin至关重要。
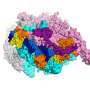
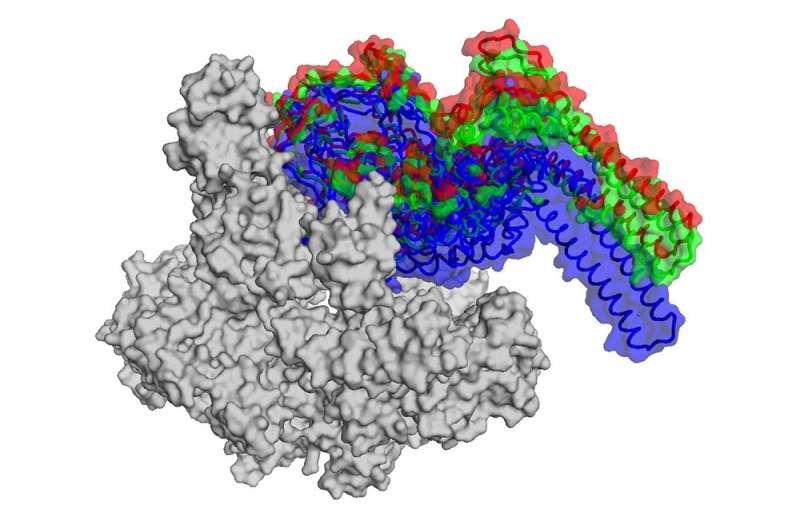
通过使用一个强大的成像技术,即低温电子显微镜,然而,坎贝尔和她的同事们能够找出如何抗生素破坏了RNAP。
张开
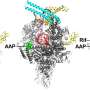
由于早期的研究,团队已经知道在结核分枝杆菌酶发现的版本才正常工作结合一种叫做RbpA-a转录因子的蛋白质没有发现在所有细菌。RbpA风使自己陷入了一个狭小的区域位于RNAP夹的底部,使其功能齐全。使用低温电子显微镜,研究人员能够显示fidaxomicin首次结合RbpA RNAP以及其他地区的深处,口袋里。
更重要的是,他们能够确定当两个分子结合在一起:fidaxomicin物理堵塞酶的夹打开,不允许它关闭。
“这就像一个门挡,防止夹保护DNA转录,”坎贝尔说。
无尽的可能性
接下来,坎贝尔和她的同事更进一步。使用非致病性的表弟叫m . smegmatis的结核分枝杆菌的细菌的小组使用一种突变形式缺乏与fidaxomicin RbpA的一部分。当暴露于fidaxomicin,分枝杆菌不能正常生长。然而,突变体能够茁壮成长,尽管抗生素的存在,对乘法和往常一样,研究人员已经证实了怀疑:RbpA是机制的一个重要组成部分,它使这些微生物容易受到药物。
药物化学家可以使用这个洞察fidaxomicin是如何工作的设计版本的抗生素通过肠道吸收,或识别其他药物也绑定RNAP口袋,与RpbA交互。抗生素要求RbpA工作将是非常有用的,因为他们只会杀死的细菌含有RbpA。抗生素杀死任意可导致显著的间接损害,消灭仁慈的细菌繁殖的阻力在更加危险的。
同时,因为所有细菌RNAP拥有相同的口袋fidaxomicin使用作为其结合位点,药物开发人员也可以使用团队的结构数据开发抗生素杀死细菌,不依靠RbpA。
“我们的希望是,制药公司将使用这些研究作为修改和设计平台抗菌素,”坎贝尔说。“他们可以使用结构分析设计只会抑制分枝杆菌的抗生素,但是他们也可能设计广谱抗生素能杀死多种细菌。”
更多信息:韩德先生Boyaci et al . Fidaxomicin堵塞结核分枝杆菌RNA聚合酶启动所需的运动通过RbpA联系人,eLife(2018)。DOI: 10.7554 / eLife.34823