研究揭示了卵巢癌的潜在新战略
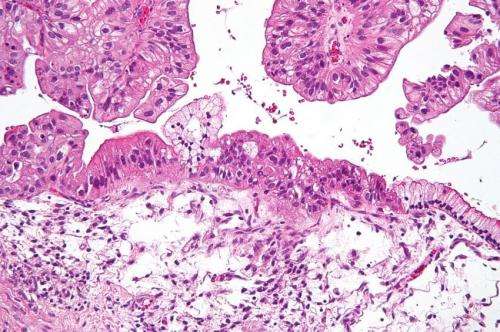
一个新的发现开辟了开发一种争夺卵巢癌的新方法的可能性。贝勒医学院和德克萨斯州德克萨斯大学癌症中心的研究人员揭示了一种以前未知的细胞途径,可选择性调节突变蛋白,称为P53-R175H,与卵巢癌生长有关。研究人员确定了该途径-USP15的关键调节因子 - 表明,在该调节者指导的药物可能导致未来控制癌症增长的更好方法。这项研究显示在自然通信。
“目前卵巢癌目前用手术和化疗治疗。化疗卵巢癌贝勒医学院(Baylor College of Medicine)分子和细胞生物学讲师、通讯作者阿库斯·帕德马纳班(Achuth Padmanabhan)博士说:“这是基于药物作用于任何快速分裂的细胞,无论是健康的还是恶性的,都有副作用。”“如果我们能够开发出只针对癌细胞的治疗方法,那么我们就有可能将副作用降到最低。”
研究表明,突变体p53蛋白可能是目标科学家一直在寻找。超过96%的高级浆液卵巢癌,最致命和常见的卵巢癌形式,在P53基因中具有突变。已经显示出这些突变在肿瘤的生产和耐药性发展中起着关键作用。正常p53.蛋白质众所周知,用于演奏肿瘤抑制作用。相比之下,Padmanabhan和他的同事-P53-R175H-研究的突变可以促进肿瘤生长。
“正常p53在最健康的细胞内迅速分解,但P53突变体如p53-r175h。它们在促进癌症和诱导耐药性的细胞内形成非常稳定的蛋白质簇,”Padmanabhan说。“研究人员发现,如果我们从癌细胞中除去突变体p53,细胞将进入细胞死亡的路径,并对化疗变得更敏感。这是从临床角度来看非常有价值。”
这些调查结果促使Padmanabhan和他的同事和其他研究人员找到减少癌细胞内部P53-R175H水平以促进自己的破坏。
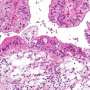
一种潜在的抗击卵巢癌的新方法
“问题是如何选择性地消除p53-r175h集群。我们不想影响正常的p53蛋白,因为这也可以导致癌症。我们的目标是找到减少突变体P53-R175H水平的方法,”Padmanabhan说。“我们不知道如何做到这一点,直到我们发现一个独特的途径,而不是调节突变体,但不是正常的p53。一旦我们识别特定的途径,我们就可以设计药物来操纵它们。”
当帕德马纳班开始在贝勒医学院(Baylor College of Medicine)乔安妮·理查兹(JoAnne Richards)博士的实验室工作时,他们正在测试一种名为MCB613的小分子,以测试它在卵巢癌小鼠模型中的治疗能力。在这些实验中,帕德马纳班观察到MCB613处理过的细胞中突变体p53蛋白迅速降低。
“这很有意思,因为它告诉我该药物正在为这种突变体做一些独特的东西,但不是其他形式的P53,”Padmanabhan说。“在这项工作中,我们试图了解MCB613的治疗如何降低P53-R175h卵巢癌细胞”。
研究人员发现MCB613不会直接降低突变P53-R175H蛋白的水平。它降低了来自P53突变体的另一个称为USP15的蛋白质的水平,该突变体靶向细胞内部的降解。
“较少的USP15分子,导致更多突变P53-R175H蛋白标记为细胞中的降解,”Padmanabhan说。“结果,消除突变体P53-R175H蛋白的平衡提示导致更多的癌细胞死亡。我们还发现突变体P53-R175H在细胞的溶酶体系统中被破坏,而不是正常的P53被另一个蛋白质降解系统分解在内细胞叫做蛋白酶。“
“我们的调查结果为通过开发抑制USP15的药物来调节突变体P53-R175H的新机会,”Richards,Michly医学院Dan L Duncan综合癌症中心成员的理查兹说,他是高级作者这项工作。“临床中可能的未来情景可以使用DNA分析来确定该P53突变是否存在于患者的肿瘤中。如果是,我们可能会使用我们的方法来对待它或将其与其他抗癌药物合并并利用用USP15的抑制剂治疗的事实结果癌细胞更容易接受化疗。”
研究人员还发现突变体P53-R175H对卵巢类固醇更敏感,因此他们正在研究卵巢类固醇如何影响卵巢癌进展。
“我们正在结合调节类固醇受体和共同疫苗行动以及P53的方法,即Celigoology and Compson Boder的分子和细胞生物学博士博士·奥马利博士博士博士表示Dan L Duncan综合癌症中心基础研究。“也许通过操纵这两个途径,我们可能有更好的机会调节癌症增长。”












用户评论