Als导致蛋白质的大骨料实际上可能有助于脑细胞
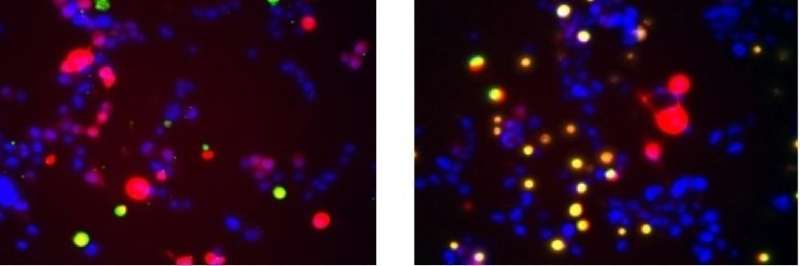
UNC学院的科学家在理解对复杂和致命的神经变性疾病的肌萎缩侧面硬化(ALS)的理解方面取得了重大进展,也称为Lou Gehrig的疾病。
ALS患者的尸检研究通常揭示叫做SOD1的蛋白质的大,纤维聚集体的积累疾病- 受理的运动神经元。研究人员已经假设这些原纤维是杀死神经元并导致某些人的原因。但在一项研究中发表的研究国家科学院的诉讼程序北卡罗来纳大学的科学家在教堂山的科学家发现,这些大型SOD1原纤维保护而不是伤害神经元。
“这可能是一个重要的发现,不仅是对ALS研究的重要发现,而且对于神经变性疾病的研究,因为原纤维聚集体的形成在这些疾病中是如此常见,”博士,博士,迈克尔·妓女的生物化学教授Unf-Chapel Hill的生物物理学。
大型,通常是纤维型蛋白质聚集体实际上是阿尔茨海默病,帕金森病,亨廷顿疾病,als和其他主要神经退行性疾病的最明显的病理特征。近年来发展的许多候选药物都设计用于清除这些蛋白质聚集体。但这些原纤维靶向策略都没有证明在大型临床试验中有效。实验室研究也很大程度上未能证明大型SOD1原纤维对神经元有害。
同时,研究人员发现,许多较小的蛋白质簇称为低聚物 - 仅由这些蛋白质的几份制成 - 可以对实验室生长的电机神经元样细胞具有高毒性,因此更有可能成为主要原因这些疾病中的脑细胞死亡。
例如,在2016年研究中,Dokholyan的实验室发现了仅仅是SOD1蛋白的三拷贝制成的“修剪”结构对ALS受影响的神经元的类型有毒。
对于新的研究,Dokholyan的团队,包括铅作家程朱,博士学位,他的实验室的博士后研究员,进行了复杂的实验,以比较Trimers如何影响神经元,以如何更大的原纤维影响神经元。
“一个挑战是,诸如三聚体的较小的结构倾向于瞬时存在于形成更大结构的途中,”朱说。“但我们能够找到稳定三聚体的SOD1突变结构体另一种突变以较小的结构为代价促进较大的原纤维的产生。因此,我们能够分离这两种蛋白质的效果。“
研究人员在测试细胞中表达了突变体SOD1蛋白,其与ALS中的肌肉控制神经元相似。他们发现 - 正如他们在2016年的研究中所做的那样 - 当这些细胞表达主要形成三聚体的SOD1突变体时,细胞比含有常规SOD1的控制细胞更快地死亡。微三聚体的细胞甚至比表达在严重遗传性ALS病例中发现的突变体形式的细胞更快地死亡。
“看着各种SOD1突变体,观察到毒性与三聚体形成程度相关的程度,”朱说。
另一方面,含有突变体SOD1的细胞的可行性,强烈地形成原纤维,但抑制三聚体倾向于与野生型SOD1相似,表明原纤维是保护的,而不仅仅是毒性。
这表明SOD1原纤维不是SOD1连接的ALS中的问题;他们可能是一个解决方案。“服用促进原纤维形成的药物可能是减少SOD1-ALS中毒性的一种方式,”Dokholyan说。
他指出,另一种策略将是限制三聚体或其他小型毒性SOD1低聚物的形成。SOD1通常工作细胞作为两拷贝结构,二聚体。三聚体和其他异常结构似乎在二聚体分开时源自起源。因此,Dokholyan和同事正在寻找可以稳定二聚体的潜在药物分子。
SOD1与ALS病例的大量比例相关联。SOD1基因中的突变占在家庭中运营的约12%的ALS案件。所有这些突变都破坏了蛋白质的正常结构并促进了SOD1结构的异常。SOD1突变也似乎占了约1.5%的病例,这些病例在家庭中没有明显运行。
“虽然SOD1-相关的ALS代表了所有ALS病例的一小部分,但揭示了SOD1聚集中神经毒性的起源可能阐明了一整套神经变性疾病的潜在原因,”Dokholyan说。Dokholyan实验室的后续步骤是针对病理三聚体SOD1的毒性毒性下游细胞机制,发现减轻三聚体形成的药物。








用户评论