瞄准白血病滋生的机制
最近在钻石光源的圆二色光束(B23)上进行的两项研究阐明了一种亚型白血病在体内增殖的方式。发表在OncoImmunology和Nanoscale不仅识别了一些与白血病进展有关的关键蛋白质,而且表明它们可以用作提供靶向治疗的停靠点。
急性髓系白血病(AML)是一种起源于白色的癌症血细胞在骨髓中称为粒细胞或单核细胞。通常采用化疗治疗,但一些患者也需要干细胞移植。尽管AML是成人急性白血病中最常见的类型,但AML细胞存活和增殖的细胞机制仍有待阐明。
由肯特大学(University of Kent)的研究人员领导的一个大型合作团队此前发现,一种被称为高迁移率群盒1 (HMGB1)的蛋白质触发AML进展。为了更详细地探索HMGB1的作用,他们使用B23来发现它是如何与其他蛋白质相互作用的。
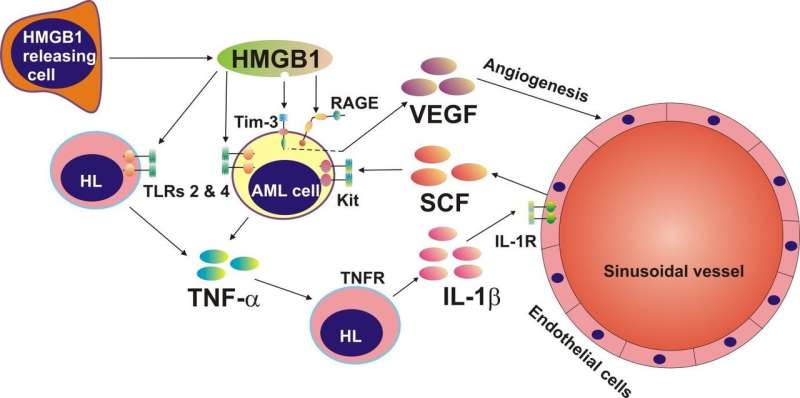
他们发现HMGB1触发了著名的癌症介质:肿瘤坏死因子-α (TNF-α)和血管内皮生长因子(VEGF)的释放,在B23的帮助下,他们还发现HMGB1作为t细胞免疫球蛋白和粘蛋白结构域3 (Tim-3)的配体。与此同时,他们用装载了称为雷帕霉素的细胞毒性药物的定制金纳米颗粒靶向AML细胞表面的Tim-3。他们发现这种药物被细胞内化,扰乱了信号通路。这些见解不仅为未来的AML治疗提供了巨大的潜力,而且它们也可能在白血病的快速诊断中发挥作用。
躲过免疫攻击
白血病是一种发生在血液和骨髓的癌症,AML只是其中四种主要亚型之一。急性髓细胞白血病采用化疗和干细胞移植积极治疗,一些新的靶向疗法目前正在进行临床试验。有趣的是,我们的免疫系统也有杀死癌细胞的能力,但AML等癌细胞却有灭活的机制免疫细胞躲过免疫攻击
当AML在骨髓中发展时,异常细胞数量的增加创造了一个紧张的环境,鼓励周围的非癌变细胞释放一种名为HMGB1的蛋白质。HMGB1有时被称为“警报”(危险信号),因为它作为一个危险信号触发信号通路和促进增殖;然而,目前还不清楚白血病是如何利用这种“警报素”的。
来自肯特大学、汉堡埃彭多夫大学医学中心(德国)、奥尔登堡大学(德国)、意大利Svizzera大学(瑞士)、伯尔尼大学(瑞士)和钻石光源的科学家们展开了一项欧洲合作,开始对HMGB1进行更详细的研究。
来自肯特大学梅德韦药学院的Vadim Sumbayev博士解释了他们的动机:“我们对恶性血细胞逃脱宿主免疫监视的机制很感兴趣。我们的长期目标是找到如何禁用癌细胞中的这些机制,这样免疫细胞就能正常工作,从而完成它们的工作并杀死癌细胞。这将避免使用化疗或骨髓移植等苛刻的治疗方法。”
干细胞因子
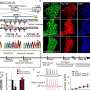
研究小组处理了带有HMGB1的AML患者的血液样本,以观察哪些蛋白质上调。他们还在B23上使用了装有高度准直微束的圆二铬酸盐,以找出哪些蛋白质与HMGB1相互作用,并对它们的二级结构进行表征。
结果表明,HMGB1可诱导AML细胞释放TNF-α,从而引发干细胞因子(SCF)的产生。在正常情况下,干细胞分裂和分化都需要SCF白细胞.然而,在AML中,SCF具有致癌性,癌细胞鼓励健康细胞为它们产生SCF,”Sumbayev博士澄清道。
B23证实HMGB1与一种叫做Tim-3的免疫受体相互作用。这种受体介导了一种叫做血管内皮生长因子(VEGF)的癌症生长因子的释放,它在血管生成中起着关键作用。
“我们的工作证明了HMGB1蛋白可能被认为是抗aml治疗的可能靶点。实际上,这进一步证实了靶向免疫受体Tim-3在抗aml治疗中的有效性。”
药物输送
从Tim-3和HMGB1中获得的知识被用于在AML细胞的平行研究中设计一种新的给药方法。
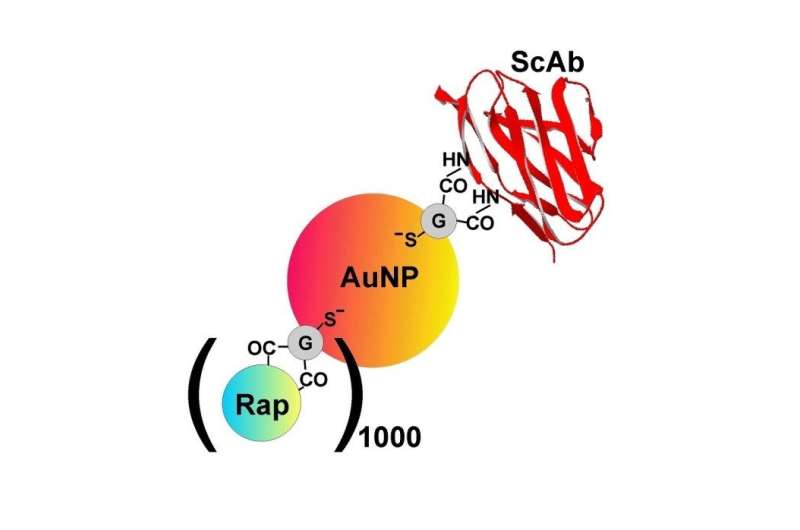
在Sumbayev博士的带领下,来自同一机构的研究人员创造了5纳米金纳米颗粒,使用针对Tim-3的单链抗体进行功能化。该团队此前进行的研究已经证明,纳米颗粒具有生物相容性,并显示出抗炎性能。
除了含有Tim-3抗体外,其余的金表面还覆盖着一种叫做雷帕霉素的细胞毒性药物。B23被用来表征纳米材料并检查其构象。桑巴耶夫博士解释说:“当你使用纳米材料时,重要的是观察蛋白质和活性成分在附着在表面时发生了什么。首先,你需要确认它们已经附着在纳米材料表面,其次,你需要看到这是如何改变活性分子的。”
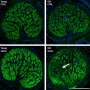
当功能化金纳米颗粒被添加到AML细胞系或来自患者的AML样本中时,药物会内化并成功阻断细胞中的生存转译通路。
尽管它们具有明显的治疗潜力,桑巴耶夫博士在他的分析中很谦虚:“这些纳米材料可能更适用于诊断而不是治疗——将纳米材料送到人体可能太难了骨髓.这种纳米材料可以快速检测出异常细胞,这非常重要,因为这种类型的癌症在儿童和老年人中很常见。早期诊断意味着可以毫不拖延地开始治疗。”
返回B23
研究小组还在AML细胞表面发现了一种新的生物标志物,称为嗜拉脂酶1。由于在健康血细胞表面没有发现这种物质,因此它可能是癌症诊断的一个非常可靠的标记物,因此它已经被肯特大学申请了专利。
但HMGB1的研究之旅并没有就此结束:“我们将进一步发现使恶性细胞逃脱免疫攻击的调控途径的机制。我们还在寻找这些途径是否只针对白血病细胞或者他们是否正常存在只是被癌症细胞桑巴耶夫博士解释道。
对于这项即将进行的工作,Sumbayev博士打算回到Diamond,他已经与B23的团队提交了联合拨款申请。
Diamond's Soft Condensed Matter Group的高级光束科学家Rohanah Hussain博士对研究结果感到兴奋:“使用B23的微准光束对于有限的样本可用性,收集系统之间相互作用的结构信息至关重要,这不仅对理解这些蛋白质如何在AML中工作,而且对开发潜在的诊断或治疗化合物至关重要。”
Inna M. Yasinska等。使用具有药理活性的纳米结合物对人类急性髓系白血病细胞的高度特异性靶向,纳米级(2018)。DOI: 10.1039 / C7NR09436A