实验性MERS治疗进入临床试验
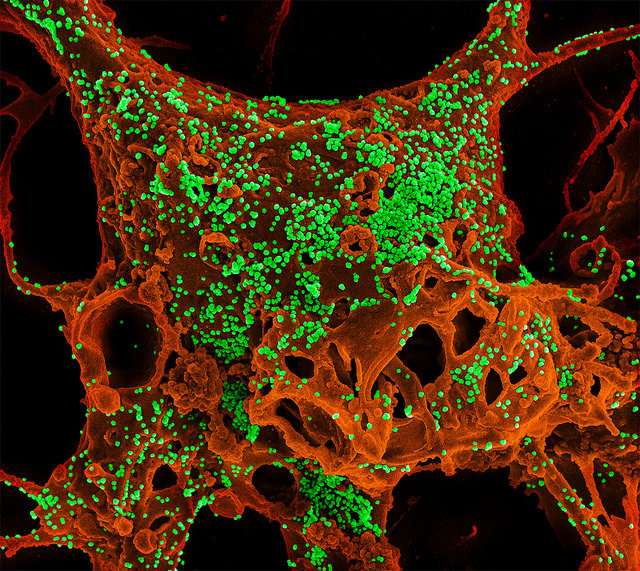
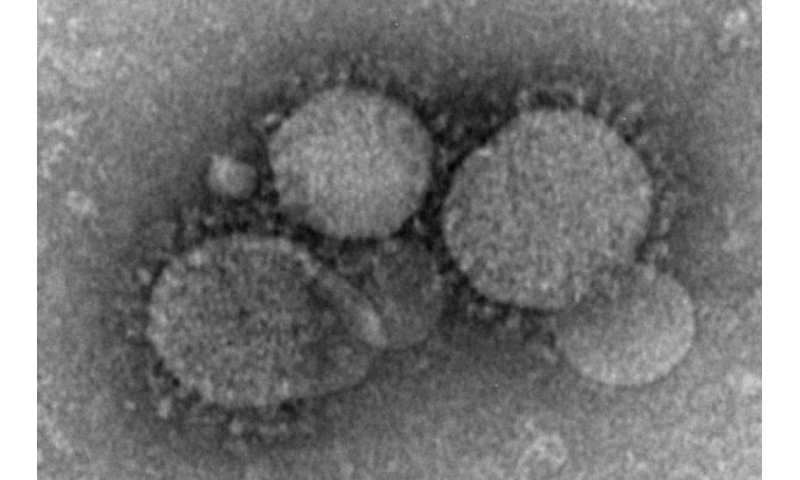
入学在早期的临床试验中开始测试两种人类单克隆抗体(MAB)的安全性,旨在治疗感染中东呼吸综合征冠状病毒(MERS-COV)的人。该审判由国家过敏和传染病研究所(NIAID),部分卫生研究院提供赞助,部分由生物医学高级研究和发展管理局资助,助理准备秘书长办公室回应,部门健康与人类服务。
2012年在约旦报道了第一个公认的Mers案例。从那时起,Mers-Cov已经蔓延到27个国家。截至5月,已向世界卫生组织报告2,206个实验室确认的案件。这些病例包括787人死亡,死亡率约为36%。
“目前,我们缺乏对MERS的特定治疗,”Niasid总监Anthony S. Fauci,M.D。
MABS,REGN3048和REGN3051被生物技术公司Regeneron的科学家发现和开发,总部位于纽约塔里尔尔尔顿。随后,Regeneron和Maryland大学医学院的研究人员展示了抗体在MERS的小鼠模型中中和MERS-COV的能力。新的NIAID试验是第一个在人们中测试这些MAB的审判。
该研究将在加利福尼亚州赛普拉斯的WCCT Global,18至45岁之间注入48岁及45年的健康成年人。参与者将分为六组八,每组中有两个人接受不活跃的安慰剂,其余六个接受静脉内递送的两种实验性mAbs。该研究是盲目的,意思是研究人员和参与者都没有知道是否正在管理安慰剂或MAB。初始队列中的参与者将获得实验抗体的最低剂量,每千克每千克(千克)的志愿者重量的每千兆比例为1.5毫克(Mgs)。连续队列中的参与者将收到增加剂量,直到第六组达到最高剂量(每种mAb的75mg / kg)。
继续审判和管理升级的MAB剂量的决定将由一名独立的安全审查委员会(SRC)制定,其成员在整个审判中都能获得安全和耐受性数据。SRC将以定期的时间间隔举行会议,以确定是否已满足任何预先建立的标准,以便暂停审判。如果没有安全顾虑,试验将继续参加参与者进入下一个更高剂量的队列。该研究预计将于2019年6月完成。
进一步探索











用户评论