基因组手术眼科疾病行动更接近现实
来自哥伦比亚大学的研究人员已经开发出一种新技术的强大基因编辑工具CRISPR恢复视网膜功能在小鼠视网膜退行性疾病的折磨,色素性视网膜炎。这是研究者们第一次成功应用CRISPR技术类型的遗传疾病称为显性障碍。这个工具可能在数百种疾病,包括亨廷顿氏舞蹈症、马凡综合征,和角膜营养不良。他们的研究发表在今天眼科学,美国眼科学会杂志》上。
斯蒂芬·h·曾荫权,医学博士博士和他的同事试图创建一个更敏捷CRISPR工具它可以治疗更多的病人,不管他们的个人基因档案。曾荫权博士称基因组技术手术,因为它削减了坏基因和取代正常,功能基因。博士曾说,他预计在三年内开始人体试验。
“基因组手术来了,”曾荫权博士说。“眼科将第一个看到基因组医学手术前休息。”
色素性视网膜炎是一组罕见遗传疾病引起的超过70个基因之一。它包括视网膜细胞的破坏和损失,光敏感组织行后面的眼睛。它通常罢工在童年和进展缓慢,影响周边视觉和晚上的能力。大多数成年早期,将失去大部分视力,成为盲人,40岁。没有治愈。据估计,全世界影响大约4000人。
自2012年推出以来,基因编辑技术称为CRISPR(定期聚集空间短回文的重复序列)已经彻底改变了速度和范围,科学家可以修改活细胞的DNA。科学家们利用它在广泛的应用中,从工程植物(无籽西红柿)生产的动物(额外的精益小猪)。但难以置信的基因组手术,CRISPR有一些缺点需要克服,才能不辜负其治愈人类疾病的宣传只是剪坏基因在好的和缝纫。
等疾病常染色体显性遗传色素性视网膜炎研究人员提出一个特殊的挑战。在常染色体显性遗传疾病,人继承了只有一个副本的一个突变基因从父母和一对常染色体上一个正常基因染色体。CRISPR-wielding科学家面临的挑战是编辑只有突变没有改变健康的一个副本。
相比之下,常染色体隐性障碍患者遗传突变基因的两个副本。当突变基因的两个副本,治疗需要更简单,一步的方法简单地替换有缺陷的基因。目前,有六个制药公司追求基因治疗视网膜色素变性的隐性形式;没有正在开发一种治疗的主导形式。但这可能很快改变。
这是因为曾荫权博士和他的同事们想出了一个更好的治疗策略常染色体显性疾病。它允许他们去掉旧的基因,代之以一个良好的基因,而不影响其正常功能。这个所谓的“ablate-and-replace”策略可以用来开发CRISPR工具集的所有类型的突变,驻留在相同的基因,而不是排斥的一种突变。这是特别有用,当许多类型的突变会导致同样的障碍。例如,任何一个150年的视紫红质基因的突变会导致色素性视网膜炎。因为曾荫权博士的技术可以应用在mutation-independent方式,它代表了一种更快、更便宜的治疗策略,克服困难主要障碍与基因组手术。
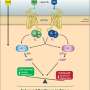
通常,CRISPR研究人员设计一个短的代码称为指南RNA序列相匹配的一些他们想要取代。他们将指导RNA叫做Cas9的蛋白质,和他们一起在细胞核,直到他们找到一个匹配的DNA片段。Cas9将DNA和指南中把RNA。然后剪坏代码和可诱导细胞接受好的代码,使用细胞的自然基因修复机器。
而不是使用一个指导RNA,曾荫权博士设计的两个指南RNA治疗常染色体显性遗传视网膜色素变性引起的视紫红质基因的变化。视紫红质是一种重要的治疗目标因为突变导致约30%的常染色体显性遗传视网膜色素变性和15%的遗传性视网膜营养不良。
这种技术允许一个更大的删除永久破坏目标基因的遗传密码。曾荫权博士发现,使用两个指南rna,而不是一个破坏坏基因的几率从30%增加到90%。他们把这个基因组手术工具与基因替代技术使用一个腺相关病毒携带基因植入视网膜的健康的版本。
另一个优势是,这种技术可以用在非区分细胞,这意味着它可以使基因疗法关注:成人细胞,如眼睛的细胞、大脑或心脏。直到现在,CRISPR已经应用在分裂细胞更有效地比非区分细胞。
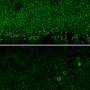
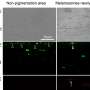
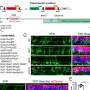
曾荫权博士使用客观视力测试来评估小鼠治疗后显示在视网膜功能显著改善。一个网膜电图通常用于评估人类视网膜的健康。它测试视网膜的健康就像心电图(EKG)测试心脏的健康。
先前CRISPR视网膜疾病的研究依赖于一个较客观衡量,包括评估频率鼠标变成一个光源的方向。博士曾用electroretinography表明视网膜变性放缓治疗眼睛与未经处理的眼睛。