肠道细菌构建微生物群的指南
哺乳动物的肠道温暖、潮湿、营养丰富得令人难以置信——这是细菌生长的绝佳环境。肠道中的“好细菌”群落,通常被称为微生物组,是身体的重要伙伴,帮助消化纤维,提取营养物质,预防各种疾病。我们都很熟悉坏的或致病的细菌进入身体后引起的免疫反应和疾病——那么,如果免疫系统的进化是为了排斥微生物,那么哺乳动物如何与肠道中的有益细菌保持和谐的关系呢?
现在,加州理工学院的一项新研究说明了一种特殊的有益的细菌实际上是利用身体的免疫反应,让它在肠道中舒服地安顿下来。
这项工作是在Sarkis Mazmanian、Luis B.和Nelly Soux微生物学教授和传统医学研究所研究员的实验室完成的。ob欧宝直播nba5月3日,该杂志在线发表了一篇描述该研究的论文科学.
在研究生格雷戈里·唐纳森的带领下,马兹马尼安实验室的研究人员选择研究一种叫做脆弱杆菌的微生物。这种特殊的物种大量存在于包括人类在内的许多哺乳动物的大肠中,马兹马尼亚实验室此前曾证明,它可以保护小鼠免受某些炎症和神经系统疾病的影响炎症性肠病和多发性硬化症。有趣的是,尽管脆弱芽胞杆菌有多种菌株,但健康的人只与一种菌株形成长期的一夫一妻制关系。
“其他实验室的研究表明,大多数人一生中都携带着相同的脆弱芽胞杆菌菌株,”唐纳森说。“我们想在分子水平上了解这些细菌是如何以稳定、长期的方式在肠道中定居的。”
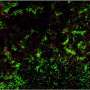
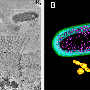
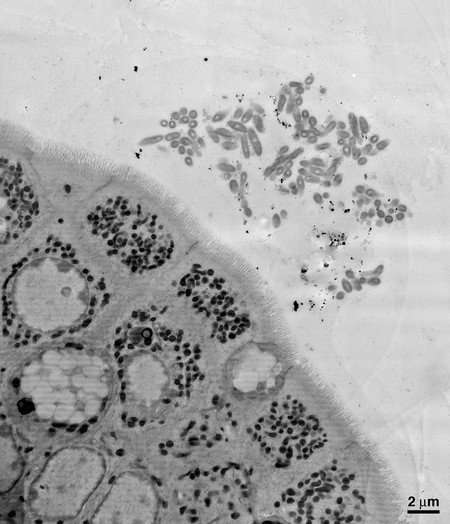
首先,研究人员旨在通过观察细菌居住的位置来研究脆弱芽孢杆菌与肠道的共生关系。通过对小鼠肠道样本进行电子显微镜成像,研究小组能够看到,脆弱芽胞杆菌在肠道粘膜的厚粘液层深处聚集在一起,依偎在肠表面的上皮细胞附近。唐纳森和他的合作者从理论上认为,这种空间生态位对于单个物种的定居和建立稳定的立足点是必要的。
该团队下一步的目标是确定是什么机制允许脆弱芽孢杆菌在肠道内的这种生态位中定居。他们发现每个脆弱芽胞杆菌都被包裹在一个由碳水化合物组成的厚囊中。这种胶囊通常与病原体(坏细菌)有关,它们试图掩盖自己,不被身体免疫系统识别和攻击。缺乏这种包膜的突变菌不能聚集,也不能栖息在粘膜层。因此,研究人员推断囊状碳水化合物是脆弱芽孢杆菌在肠道中垄断其生态位所必需的。

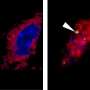
因为已知细菌胶囊与致病菌的免疫反应有关,Donaldson和Mazmanian假设脆弱芽孢杆菌胶囊可能也有免疫反应。事实上,他们发现抗体和免疫蛋白抓住并标记特定的细菌或病毒,让其他免疫细胞吞噬和摧毁,并与肠内的脆弱芽孢杆菌囊结合。一种特殊的抗体,免疫球蛋白A或IgA,在整个肠道中都能找到——事实上,它是人类体内产生最多的抗体类型——但它的具体功能一直是个谜。
通常情况下,抗体反应意味着致病菌即将死亡。但奇怪的是,IgA并不会对大多数正常生活在肠道中的细菌产生负面影响。在脆弱芽孢杆菌的例子中,研究人员发现,它实际上帮助细菌粘附在上皮细胞上。此外,在缺乏IgA的小鼠中,这种细菌在肠道表面定植和保持长期稳定的成功率较低。
研究小组认为,这种对脆弱芽孢杆菌荚膜的IgA反应有助于将细菌固定在上皮表面,从而提供了优势。
“令人惊讶的是,我们发现免疫反应实际上有助于有益细菌的繁殖,这反过来又有助于宿主的繁殖,”唐纳森说。免疫学的研究主要是在病原菌.但肠道里有数万亿的细菌,大多数时候它们都不会让你生病。我们的研究表明,对这些细菌有积极的免疫识别,但它帮助而不是阻碍它们。这表明免疫系统不仅仅是一个防御系统,抗体不仅仅是武器。”
在未来的工作中,研究人员计划研究肠道抗体反应最初是如何产生的,以及为什么它帮助了脆弱芽胞杆菌,而其他抗体却伤害了细菌。最终,这项工作可以通过使用益生菌来改善其他有益细菌的定植。
马兹马尼安说:“在过去的十年里,许多研究对肠道微生物群在各种疾病、生活方式、地理位置和出生后的情况进行了分析。”“我们已经了解到,微生物组的群落组成与特定的条件相关——例如,改变的微生物组配置可能导致炎症性肠病、自闭症和帕金森氏症。微生物群最初是如何建立和维持的,这在很大程度上是未知的。我们的研究揭示了一种分子机制细菌积极促进长期的肠道定植,通过参与和吸收免疫系统,而不是像病原体一样试图逃避它。这一发现可能会带来纠正微生物群失衡的新方法,或许还能预防和治疗各种人类疾病。”
这篇论文的题目是“肠道菌群利用免疫球蛋白A进行粘膜定植”。
进一步探索