神经科学家发现了与阿尔茨海默氏症有关的基因的作用
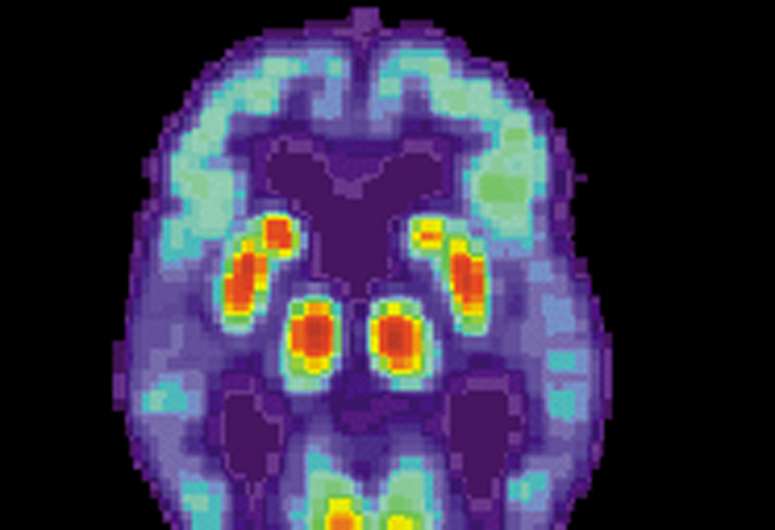
具有叫做ApoE4的基因变体的人具有更高的发展后期阿尔茨海默病的风险:ApoE4是阿尔茨海默氏症患者中的三倍,而不是一般人群。然而,对于为什么这种形式的apoE基因的帕福基因众所周知,这通常涉及代谢和脂肪分子如胆固醇的运输,赋予阿尔茨海默氏症的风险更高。
为了阐明这个问题,麻省理工学院神经科学家对APOE4和更常见的基因,APOE3进行了综合研究。学习大脑细胞研究人员发现,研究人员源自一种诱导的人干细胞,发现APOE4促进了β淀粉样蛋白的积累,这使得在阿尔茨海默氏症患者的大脑中看到的特征斑块。
“ApoE4影响我们研究的每种细胞类型,以促进阿尔茨海默氏症病理学,特别是淀粉样淀粉的发展,”麻省理工学院的学习和记忆研究所和学习高级作者李亨伊·蔡·李···蔡说。
研究人员还发现,通过编辑基因将其转化为apoE3变体,它们可以通过ApoE4消除阿尔茨海默氏症的脑细胞迹象。
Picower学院研究科学家元塔林和前博士后锦索SEO是本文的主要作者,出现在5月31日在线版本神经元。
淀粉样蛋白积累
Apoe,也称为载脂蛋白E,有三种变体,称为2,3和4.PoO在细胞环境中与胆固醇和脂质结合,使细胞能够吸收脂质。在大脑中,称为星形胶质细胞的细胞产生脂质,然后在帕托的帮助下被神经元分泌并占用。
在一般人群中,约有8%的人有ApoE2,78%的ApoE3,14%有ApoE4。然而,在患有晚期的人们中,非血统阿尔茨海默氏症,占所有病例的95%,概况截然不同:只有4%的APOE2,APOE3下降到60%。Apoe4显示出戏剧性增加:37%的晚期Alzheimer的患者携带此版本的基因。
“ApoE4是迄今为止最重要的风险基因,零星的阿尔茨海默病,”Tsai说。“然而,尽管如此,它对此进行了很多研究。我们仍然没有非常好的想法为什么apoe4增加疾病风险。”
以前的研究表明,具有APOE4基因的人具有较高水平的淀粉样蛋白,但很少是已知的。
在这项研究中,麻省理工学院的研究小组开始用人类诱导的多能干细胞来回答这个问题——来自皮肤或其他细胞类型的干细胞。他们能够刺激这些干细胞分化成三种不同类型的脑细胞:神经元、星形胶质细胞和小胶质细胞。
利用基因编辑系统CRISPR/Cas9,研究人员将健康人干细胞中的APOE3基因转化为APOE4。因为除了APOE基因外,这些细胞在基因上是相同的,所以它们之间的任何差异都可以归因于该基因。
在神经元中,研究人员发现,表达APOE3和APOE4的细胞有数百种不同的表达基因在APOE4细胞中,大约有250个基因下降,190个基因上升。在星形胶质细胞中,数量甚至更高,而在所有小胶质细胞中数量最高:在APOE4小胶质细胞中,超过1100个基因表现出活性降低,而300个基因变得更活跃。
这些基因变化也转化为细胞行为的差异。携带APOE4的神经元形成更多的突触,并分泌更高水平的淀粉样蛋白。
在Apoe4星形胶质细胞中,研究人员发现胆固醇代谢高度疑虑。将细胞产生的两倍多的胆固醇作为ApoE3星形胶质细胞,以及它们从其周围环境中除去淀粉样蛋白蛋白的能力急剧损害。
微胶质细胞同样受到影响。这些细胞,其正常功能是帮助消除异物,包括淀粉样蛋白蛋白和细菌等病原体,当它们有ApoE4基因时,在这项任务中变得更加慢。
研究人员还发现,他们可以通过使用CRISPR/Cas9将诱导产生的脑细胞中的APOE4基因转化为APOE3,从而逆转大部分这些影响干细胞一个患有晚发型阿尔茨海默病的病人
破坏细胞的行为
在另一个实验中,研究人员从众所周知的基因的细胞产生三维“有机体”或微型大脑,这是众所周知的基因。这些有机体具有高水平的淀粉蛋白聚集体,但是当它们暴露于ApoE3微胶质胶质胶质时,大多数聚集体被清除。相比之下,ApoE4小植物没有有效地清除聚集体。
蔡说,她认为Apoe4可能会破坏特定的信令途径脑细胞,导致研究人员在本研究中看到的行为的变化。
“从这种基因表达分析中,我们可以缩小到Apoe4的某些信号通路,”她说。“我认为这绝对可以揭示治疗干预的潜在目标。”
这一发现还表明,如果基因编辑技术能够在人类身上发挥作用(许多生物技术公司正在努力实现这一目标),就可能为治疗携带APOE4基因的老年痴呆症患者提供一种方法。
“如果你能把基因从E4转换到E3,许多阿尔茨海默氏症的相关特征就可以减少,”Tsai说。














用户评论