在肌营养不良型1型比替代拼接更常见
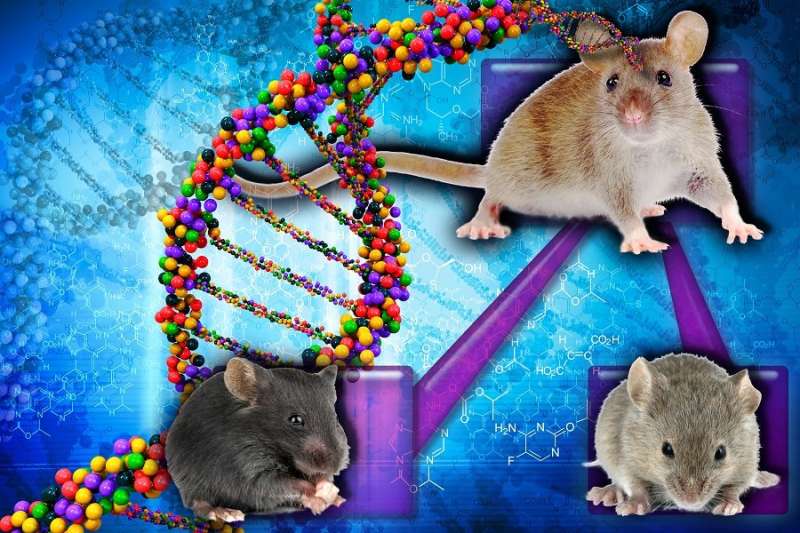
肌强直性肌营养不良1型(DM1)是最常见的成人发病肌营养不良,影响多个器官系统。患有这种疾病的人会在他们的小腿、手、脖子和脸部出现渐进性的肌肉萎缩和无力。他们的肌肉感到僵硬和紧绷,导致他们的某些肌肉放松缓慢,因此很难从握手或门把手上松开。此外,患有这种疾病的人可能会出现疲劳、肌肉疼痛、吞咽困难、白内障、心跳异常和呼吸并发症。在贝勒医学院(Baylor College of Medicine)的实验室里,托马斯·a·库珀(Thomas A. Cooper)博士正在引领人们更好地了解这种罕见但致命的疾病。
“肌肉浪费了疾病超过几十年的情况发生,负责60%的患者的死亡,“Cooper表示,他是病理学和免疫学教授,分子和细胞生物学以及贝勒医学院的分子生理学和生物物理学。”在这研究我们想开发一个小说模型允许我们学习的疾病肌肉更详细地浪费。“
DM1是由DMPK基因中三字母重复序列(CTG)的显著扩增引起的。未受影响的人群携带5到37次重复,而有这种情况的人携带50到3000次重复。含有CTG重复扩增的RNA转录本在细胞核中积累。这扰乱了正常细胞分子的加工和分布,如肌盲样(MBNL)蛋白,并诱导其他蛋白的上调,如CELF1蛋白。这些改变导致了异常的选择性剪接,这被认为在DM1的发展中起着核心作用。然而,由CTG重复序列的扩张所引发的这些变化如何导致肌肉萎缩仍不完全清楚。
“我们认为DM1的目前的动物模型不为研究人员提供完整实用的工具来调查肌肉损失的机制,”库珀实验室的第一个作者博士·莫里斯博士博士和这项工作的第一个作者博士说。“这种疾病有许多不同的组件。目前的动物模型具有一些分子组分,但生理成分,组织发生的事情大多都缺失。我们想开发一个鼠标模型DM1清楚地表现出肌肉损失,并实施一种允许我们研究患有肌肉浪费的途径的策略。“
可逆DM1的鼠标模型
研究人员遗传设计了DM1的骨骼肌特异性小鼠模型,允许它们诱导疾病的发展。当诱导时,小鼠表达了人DMPK基因的特定区域的960次突发突发,含有含有突出的COL核内积聚的突发葡萄球菌的RNA转录物,引发导致渐进式肌肉浪费的事件链。当研究人员关闭960 CUG重复的表达时,RNA积聚和肌肉损失逐渐恢复。
在这个模型中,研究人员看到了与之前研究中发现的与肌肉无力相关的选择性剪接。他们还验证了之前被其他人发现的信号通路变化。重要的是,他们发现了之前没有描述过的信号通路变化。这些新变化有多么严重肌肉浪费在小鼠中,显示了特定的信号通路和肌肉损失。
“我们验证了蛋白质AMPK-α活性的上调,该蛋白质AMPK-α的活性在另一个模型中以前通过另一组显示。AMPK-alpha调节肌肉代谢和功能的方式,”Morriss表示。“我们模型中发现的新变化之一是PDGFR-β介导的信号活动的显着降低,这参与能量代谢途径。”
此外,Cooper,Morriss及其同事发现与人类状况有关。他们分析了来自患者的人类组织样本和未受影响的个体,并在患者中发现它们在其小鼠模型中发现的相同的信号通路变化。
“该领域一直专注于替代拼接。但是,我们的发现告诉我们的一件事是,尽管这种疾病的许多特征是由选择性剪接缺陷导致的,此外还有其他机制在起作用,因此有其他潜在的靶点来治疗这种疾病。库珀说。他也是S. Donald Greenberg、R. Clarence和Irene H. Fulbright的教授,也是贝勒大学Dan L Duncan综合癌症中心的成员。
“现在我们有一个鼠标模型,我们可以测试涉及疾病所涉及的机制。因为我们使我们的模型可逆,我们可以使用它来测试关于重复造成疾病特征的假设。我们可以系统地测试每一个这些假设在我们的模型中独立地阻止了每个信令事件,具体并确定影响疾病的程度。我们可以以这种方式确定每种疾病组分,信号通路和信号替代拼接库珀说。













用户评论