FDA授予第一个批准CA药物新试点项目

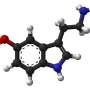
(每日健康)- - -美国食品和药物管理局已批准ribociclib (Kisqali)结合芳香化酶抑制剂(AI)作为初始endocrine-based疗法治疗前/准更年期或绝经后妇女激素受体(HR)阳性,人类表皮生长因子受体2 (HER2) -高级或转移性乳腺癌。
Ribociclib也被批准fulvestrant作为初始endocrine-based疗法或内分泌治疗后疾病进展绝经后妇女HR-positive her2阴性先进或者转移性乳腺癌。这是首家获批的,FDA已经批准了两个新的试点项目的一部分,旨在提高抗癌药物的开发和评审效率和改善其标准评价疗效和安全性。
ribociclib的功效是演示前/准更年期妇女在临床试验中,495名参与者收到ribociclib和AI或安慰剂和人工智能;无进展生存期更长了,病人服用ribociclib与安慰剂(中位数,27.5和13.8个月)。治疗先进或者转移性乳腺癌,试用726名参与者收到ribociclib fulvestrant或安慰剂和fulvestrant表明,中位无进展生存时间服用ribociclib(中位数,分别为20.5和12.8个月,)。ribociclib的常见不良反应包括感染、中性粒细胞减少、白血球减少症、头痛、咳嗽、恶心、疲劳、腹泻、呕吐和便秘。
“批准添加一个新的乳腺癌患者治疗选择,”Richard Pazdur医学博士FDA肿瘤卓越中心的主任,在一份声明中说。
版权©2018每日健康。保留所有权利。