蛋白质聚集在ALS和FTLD中的分子罪魁祸首
突变和聚集的FUS蛋白与两种神经退行性疾病有关:肌萎缩侧索硬化症(ALS)和额颞叶变性(FTLD)。Ludo Van Den Bosch (VIB-KU Leuven)教授领导的研究人员利用一个新开发的果蝇模型,专注于FUS的蛋白质结构,以进一步了解它是如何导致神经元毒性和疾病的。
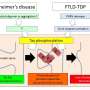
肌萎缩侧索硬化症和FTLD是成人发病的神经退行性疾病,在其引起的症状和影响的神经元方面有所不同。在肌萎缩性侧索硬化症中,控制肌肉运动的神经元退化,导致进行性瘫痪,而FTLD影响特定的大脑区域,导致痴呆。尽管如此,许多患者同时表现出这两种疾病的症状,所以科学家和临床医生现在相信,他们实际上处于同一疾病谱系的两端。
ALS和FTLD之间的重叠不仅在临床中很明显,而且在观察潜在的疾病机制时也很明显。例如,FUS与这两种疾病都有关联。FUS基因突变导致家族性ALS和FUS聚集蛋白质在ALS和FTLD中观察到。
从液滴到不溶性聚集体
FUS通常位于细胞核内,但当细胞受到应激时,FUS会转移到细胞质中的应激颗粒上。应力颗粒基本上液滴在细胞中,在ALS和FTLD中发现的含量与有毒蛋白质聚集体相似,但它们的组装是动态和可逆的。
这些液体滴作为疾病典型聚集体形成的垫脚石?“我们相信是这样的,”Elke Bogaert说,他是Van Den Bosch教授的研究人员之一。“在试管中,FUS液滴和水凝胶都被证明可以转变为不可逆的纤颤,但这一过程还没有在细胞环境中进行研究。”
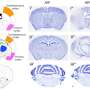
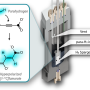
该团队产生了Fus毒性的果蝇模型,以更详细地研究液滴的形成。它们确定了两种不同的蛋白质区之间的先前无法识别的协同效应,介导毒性。“我们发现,在ALS和FTLD中行为不端的Fus蛋白可以通过疏水和带电氨基酸之间的特定分子相互作用形成液滴,”史蒂文Boynaems是一项研究的另一个研究人员,史蒂文Boynaems涉及的另一个研究人员通常被认为是介导的聚集,但新发现表明,在细胞胁迫颗粒中的FUS中,还需要蛋白质的另一个区域中的精氨酸残留物。
苍蝇和人类的问题?
进一步的实验在该蛋白质相互作用的重要性下立即暗示。Boynaems说:“我们表明,恰好这两种蛋白质结构域之间的相互作用可以解释我们的果蝇模型中的毒性,这表明蛋白质也可以在患者中误解。”
骰子游戏教授Van Den博世强调的重要性,找出确切的水滴的这种所谓的相分离过程,成熟到总量:“解密如何以及为什么蛋白质如付开始聚集在大脑中会理解的关键神经退行性疾病,可能导致新的治疗策略。我们的新发现强调了在这些蛋白质的病理中富含精氨酸的区域的重要作用。”
进一步探索









用户评论