一种可靠、易于使用的研究骨转移的小鼠模型
一项研究发表在自然通讯日本东京工业大学(Tokyo Tech) Takahiro Kuchimaru和Shinae Kondoh领导的一组研究人员提出了一种改进的小鼠模型,可能会彻底改变骨转移研究。他们的方法是通过老鼠尾巴上所谓的尾动脉注射癌细胞,克服了传统小鼠模型的许多局限性。因此,新模型可以为骨转移和癌症进展的治疗策略的发展打开新的篇章。
众所周知,转移是指肿瘤的扩散癌症细胞从原发肿瘤转移到身体其他部位是导致肿瘤的主要原因之一癌症人类的死亡率。骨转移通常发生在癌细胞扩散到骨骨例如,前列腺、乳房、肺和肾脏的肿瘤。
实验鼠标模型提供了关于癌细胞如何增殖以及如何开发治疗方法的重要线索。在过去的20年里,a模型基于心内注射(IC)的骨转移被认为是诱导骨转移的“金标准”。该模型包括将癌细胞直接注射到小鼠心脏的左心室。它需要高度的技术专业知识,即使成功执行,每次可以注射的癌细胞数量也是有限的。另一个缺点是IC模型往往更适合研究转移能力相对较高的癌细胞系,排除了对“较弱”癌细胞系的分析。
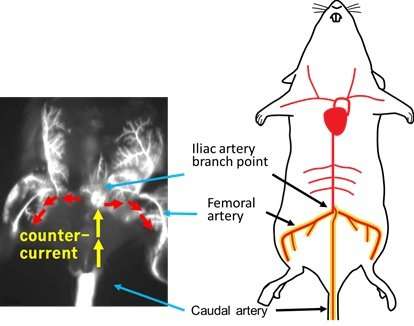
相比之下,Kondoh的团队开发的新方法是通过小鼠尾部的尾动脉(CA)注射癌细胞——由于动脉在体表可见,因此这个过程可以更容易地进行。(见图1和图2。)这种方法允许研究人员在不造成急性死亡的情况下注射更多数量的癌细胞:在目前的研究中,大约100万细胞都没有发生急性死亡此外,该方法还为研究具有低骨转移潜力的癌细胞株提供了新的途径。
研究人员强调,CA模型主要确保骨转移在后肢以更高的效率发展。
使用生物发光(BL)成像,该团队能够在所有检查的细胞系注射CA后5到12天检测到骨转移。
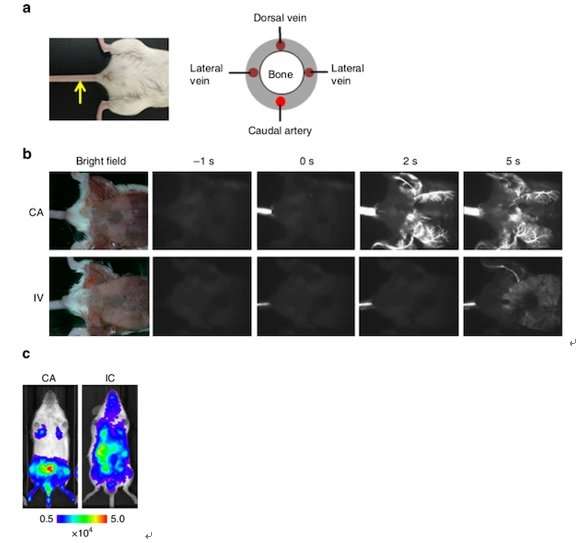
他们写道:“总的来说,结果表明,CA注射提供了一种可靠的方法,通过增加各种癌细胞系到小鼠后肢骨髓的输送效率,来发展骨转移。”
此外,与IC模型相比,CA模型使科学家能够在更长的时间内监测骨转移的进展,因为它减少了其他器官的致命转移发生率。这代表着在更深入地研究癌细胞休眠和再激活方面向前迈出了一大步。
研究人员总结道:“我们的模型可能为了解骨转移过程和开发预防药物开辟了一条新的途径骨转移和复发。”