重新思考神经退行性疾病治疗:针对多种病理蛋白,而不仅仅是一种
几乎所有主要的神经退行性疾病——从阿尔茨海默氏症到帕金森氏症——都是通过四种失控蛋白中的一种来定义和诊断的:tau蛋白、淀粉样蛋白- β (Aβ)、α-突触核蛋白(α-syn)或TDP-43。因此,旨在预防或减缓疾病的研究性药物和研究往往只针对这些各自的蛋白质中的一种。然而,根据最近发表在《科学》杂志上的一项研究,一次针对多种蛋白质——被称为“蛋白质病变”——可能是真正的关键大脑宾夕法尼亚大学医学院的研究人员
这些所谓的“蛋白质病变”——积聚和破坏神经元的错误折叠蛋白质——在所有不同的神经退行性疾病中不同程度地共存,并可能相互刺激,导致许多老年患者疾病的严重程度。这些共同病理的流行表明,每种疾病最终可能需要针对多种疾病蛋白的联合治疗,而不仅仅是针对早期和晚期疾病患者的单一治疗。
“从历史上看,大多数临床试验的重点一直是针对特定神经退行性疾病的主要病理蛋白,如阿尔茨海默病的tau和a β沉积,但我们现在看到,许多与疾病相关的聚集蛋白影响了大多数老年患者的临床和神经病理表现。”资深作者John Q. Trojanowski说,他是宾夕法尼亚大学衰老研究所的病理学和实验室医学教授和主任。“这为我们提供了额外的杠杆作用,可以通过越来越复杂的生物标志物和成像技术找到检测患者特定蛋白质病变的方法。这将使我们和其他研究人员能够在临床试验中更好地为参与者匹配特定的靶向治疗。”
这项研究分析了宾夕法尼亚大学神经退行性疾病研究中心(CNDR)的766个解剖过的大脑,结果显示,患有更严重疾病的患者有更多的共病。研究人员还发现,年龄的增长和APOE ε4等位基因的存在——一种与迟发性阿尔茨海默病风险增加相关的典型基因变异——是共同病理的危险因素。
研究人员研究了患有以下疾病的患者:阿尔茨海默病,皮克病,皮质基底变性(CBD),进行性核上性麻痹,多系统萎缩,帕金森病伴和不伴痴呆,路易体痴呆,以及伴TDP-43的额颞叶变性,肌萎缩性侧索硬化症和原发性年龄相关的tau病(PART)。
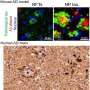
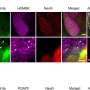
虽然在阿尔茨海默病和路易体病中观察到共同病理,但在其他疾病中很少报道tau、Aβ、α-syn和TDP-43共同病理神经退行性疾病.
CNDR的研究人员发现,共病很常见,但在不同的疾病组中有所不同,共病患者的比例从27%到81%不等。例如,52%的以tau蛋白为主要蛋白的CBD患者存在多种其他神经退行性疾病蛋白沉积。
Tau几乎是普遍存在的,92%到100%的患者至少有一种形式。其次是Aβ, 20%到57%的患者至少有一种蛋白质沉积,而α-syn病理,通常在帕金森氏症中看到,不太常见,只有4%到16%。TDP-43沉积,是典型的病理特征额颞叶变性和肌萎缩侧索硬化症,是最罕见的,只有0到16%的患者有这些沉积物。
在一些神经退行性疾病中,共病增加更为显著。例如,在阿尔茨海默病患者(tau和a β沉积是主要特征)中,α-syn病理-类似路易体的病理-增加了55%,TDP-43增加了40%。
研究结果不仅显示了共同病理的高患病率,而且表明患者的主要病理蛋白可能影响共同病理的患病率和严重程度,如阿尔茨海默氏症和路易体病患者。
在中度阿尔茨海默病患者和高级阿尔茨海默病患者之间,多重共病的存在从9%增加到25%,在脑干或杏仁核的路易体病和更严重的新皮质路易体病之间,从0%增加到21%。
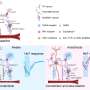
这些发现支持了先前在神经退行性疾病模型系统中建立的“蛋白质病播种”假说。错误折叠的蛋白质可能会直接“交叉播种”其他正常的、脆弱的蛋白质,通过有毒蛋白质的细胞间转移而积聚和聚集。
“我们的研究是了解共同病理在所有神经退行性疾病中存在和影响的程度的重要的第一步,”合著者弗吉尼亚m.y。dr . Lee博士,CNDR主任,病理学和检验医学教授。“现在我们需要探测这些蛋白质对蛋白质更密切地相互作用,以更好地了解它们是如何进展的病人着眼于临床研究,结合靶向治疗来阻止或减缓这些物质的积累疾病蛋白质。”