研究在动物模型中安全地提供了基于rna的基因治疗ALS
马萨诸塞大学医学院的克里斯蒂安·穆勒博士和罗伯特·h·布朗博士的一项有前景的新研究提供了证据,证明使用合成小rna的疗法可以安全地治疗肌萎缩性侧索硬化症(ALS)患者,也被称为卢·格里格氏症。这项研究出现在科学转化医学该研究表明,通过病毒载体传递给运动神经元的基因疗法能够抑制与肌萎缩性侧索硬化症相关的SOD1蛋白突变,而不会产生任何副作用。
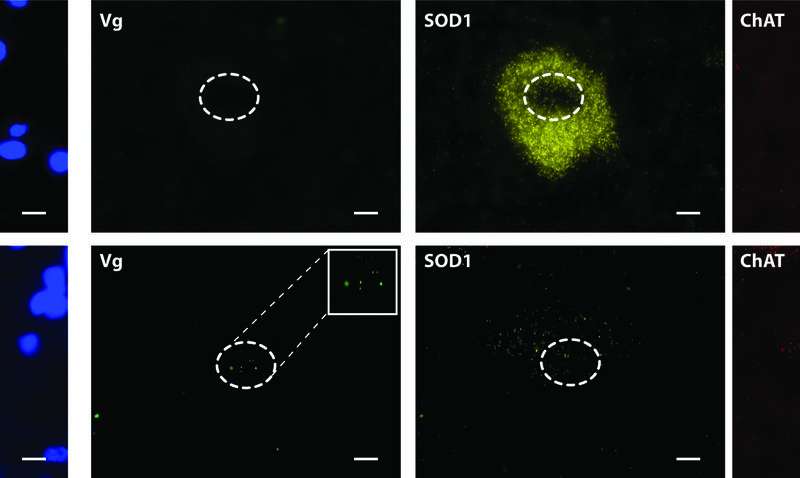
“这项研究的美妙之处在于,我们能够在一些试验中实现SOD1蛋白的沉默超过90%运动神经元穆勒博士说。他是马萨诸塞大学医学院的儿科副教授,也是UMMS Horae基因治疗中心的成员。ob体育开户网址这种程度的沉默,加上缺乏的不利影响的研究表明,这种治疗肌萎缩性侧索硬化症的方法对人类是安全的,而且治疗也可以一次性完成。”
ALS是一种累进的神经退行性疾病,影响中枢神经系统的运动神经元。据估计,美国每年有6000人被新诊断出患有这种疾病。随着运动神经元的死亡,大脑向身体肌肉发送信号的能力受到损害,导致随意和非随意肌肉运动的丧失,瘫痪并最终死于呼吸衰竭。ALS患者的平均存活率是3到5年。1993年,由马萨诸塞大学医学院神经学主任、医学博士小罗伯特·h·布朗(Robert H. Brown Jr.)领导的一个研究小组发现了第一个与家族性肌萎缩性侧索硬化症有关的基因,一种被称为超氧化物歧化酶(superoxide dismutase, SOD1)的蛋白质抗氧化剂。只有10%的ALS病例是家族性的,而大约90%是散发性的,这意味着没有可识别的家族风险或家族历史。
功能SOD1基因突变,如目标在本出版物中描述的实验,占20%的所有继承ALS的情况下,虽然SOD1错误折叠的蛋白质也被确认在其他所谓的“零星”ALS的情况下,使其成为可能的治疗目标。抑制突变体的表达是治疗这些病例的有效方法基因或者减少错误折叠蛋白质的数量。人们相信,通过这样做,导致运动神经元死亡的神经毒性可以避免或可能逆转。靶向这些基因的一种方法是使用microrna。MicroRNAs是植物和动物中自然RNA沉默机制的一部分。这些小的非编码RNA与信使RNA上的互补序列配对,使它们不稳定,这样细胞就不能将这些分子转化为蛋白质。科学家们相信,利用这种细胞机制,他们可以有效地“关闭”导致疾病的有毒基因和蛋白质。
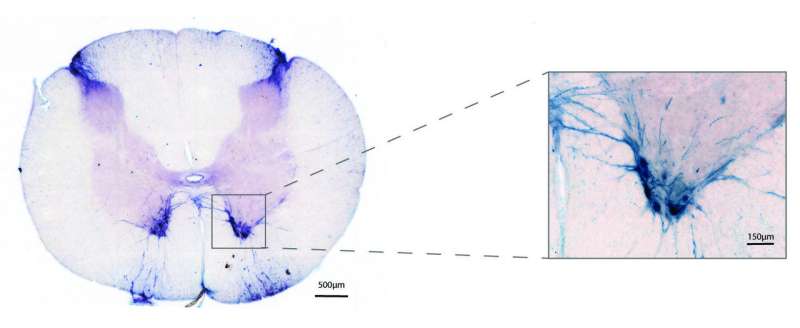
在小鼠模型中已经证实,沉默SOD1可以增加生存时间,并减少肌肉损失和呼吸损伤。在这项研究中,Mueller和同事们评估了一种来自恒河猴的腺相关病毒在恒河猴体内传递人工microrna以沉默SOD1基因的能力。
超过180种不同的SOD1基因突变与肌萎缩侧索硬化症有关。为了解释所有这些导致疾病的变异,穆勒实验室的科学家们确定了这些不同变异的DNA序列的共性。这使得他们能够使用能够瞄准尽可能多的不同SOD1突变的RNA序列来合成药物。“否则,每个独特的突变序列都需要自己的药物来抑制,”穆勒说。“这种方法允许我们用一种药物针对绝大多数SOD1突变患者。”
通过脊髓液输送药物表明,腺相关病毒能够在整个运动神经元中表达它的货物,运动神经元可以长达3英尺,从肌肉到脊柱到大脑。一旦被释放,这些病毒使用RNAi治疗,减少运动神经元中SOD1蛋白的产生多达93%。Mueller及其同事还表明,miRNA药物不会引起肝毒性,病毒载体也不会引起免疫反应。类似地,具有相似序列的基因的脱靶沉默,经常引起许多人的关注基因治疗技术,未检测到。
穆勒说:“这表明,我们有一个伟大的方式,将基于rna的药物递送到正确的细胞,足够的数量,我们应该能够通过一次性治疗沉默致病基因。”“这些实验正处于一个需要进一步发展、转化为患者临床试验的阶段。”











用户评论