鼠标研究揭示了关于癌症药物在试验中的机制
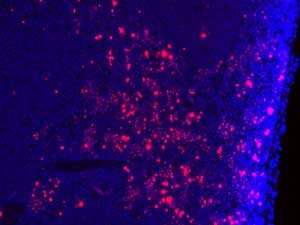
对细胞分裂至关重要的蛋白质可能有助于解释为什么某些癌症治疗在某些患者比其他患者更有效。这种蛋白质的转基因调节有助于*星级研究人员更好地理解支撑目标相同监管过程的新癌症疗法的机制。
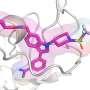
细胞分裂需要细胞周期依赖性激酶1(CDK1);它的缺失在胚胎发育过程中会导致死亡。然而,升高的CDK1活动是所有癌症的特征,并驱动细胞增殖肿瘤生长所需。因此,CDK1活性在体内紧密调节。
该调节的一个方面涉及抑制CDK1活性以防止在细胞周期的错误阶段引发分裂。在细胞周期期间的几种检查点触发下游途径,导致在CDK1上的两个位点处导致磷酸化。这种磷酸化是新癌症治疗的靶标,称为WEE1抑制剂,目前在临床试验中进行测试。
“CDK1抑制过程已经在酵母和哺乳动物中进行了广泛研究细胞但不是在动物中,“菲利普卡尔多斯从A *星级分子和细胞生物学研究所解释,他是新工作中的高级调查员。”我们的目标是在检查点废除检查点时研究体内发生的事情将我们的遗传模型与Wee1抑制剂的影响进行比较。“
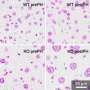
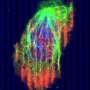
研究人员使表达突变形式的CDK1的小鼠不能在两个关键位点磷酸化。突变体CDK1在早期胚胎中致死,进一步的实验表明,其表达导致大量DNA损伤和引发细胞分裂在错误的时间。
突变体CDK1与WEE1抑制剂的影响的比较表明,虽然两种方法靶向相同的调节途径,但它们的作用机制不同。具体地,与突变体CDK1不同,WEE1抑制剂的效果取决于P53的表达水平,肿瘤抑制基因是癌症的核心。没有p53的功能活动,活动CDK1甚至更高,并且WEE1抑制剂的益处更大。
“我们的研究结果可以理解地解释了为什么Wee1抑制剂在P53基因中丧生或缺失的癌细胞中更好地工作,”Kaldis说。“这很重要,因为P53在所有癌症的约50%中突变。”
Kaldis说下一步是使用这些信息来通知癌症治疗选择。“我们的作品表明,应优先考虑患有P53突变或缺失的肿瘤患者的WEE1抑制剂,”他结束。












用户评论