基因疗法可持久逆转小鼠先天性耳聋
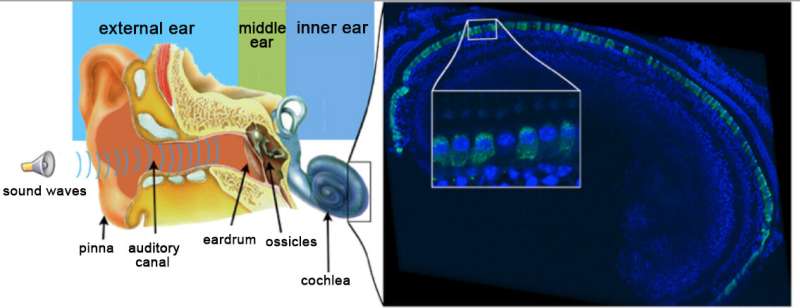
在与迈阿密大学、哥伦比亚大学和旧金山大学的合作中,来自巴斯德研究所、Inserm、CNRS、Collège de France、索邦大学和克莱蒙特奥弗涅大学的科学家们已经恢复了一个成年小鼠DFNB9耳聋模型的听力,这种耳聋是最常见的先天性遗传性耳聋案例之一。患有DFNB9耳聋的人是重度耳聋,因为他们缺乏耳费蛋白的基因编码,这是一种在听觉感觉细胞突触传递声音信息所必需的蛋白质。通过在成年DFNB9小鼠模型中进行这种基因的耳蜗内注射,科学家们成功地将听觉突触功能和听觉阈值恢复到接近正常水平。这些发现发表在杂志上PNAS,为未来在DFNB9患者中进行基因治疗试验开辟了新的途径。
超过一半的非综合征性深度先天性耳聋病例有遗传原因,其中大多数(~80%)是由于常染色体隐性耳聋(DFNB)。目前,人工耳蜗植入是这些患者恢复听力的唯一选择。
腺相关病毒(AAVs)是治疗性基因转移治疗人类疾病最有前途的载体之一。基于aav的基因疗法是治疗耳聋的一种有前途的治疗选择,但其应用可能受到狭窄的治疗窗口的限制。人类的内耳发育在子宫内完成,大约在怀孕20周时才有可能听到声音。此外,遗传形式的先天性耳聋通常在新生儿期诊断。因此,在动物模型上的基因治疗方法必须考虑到这一点,当听觉系统已经就位时,必须在基因注射后证明基因治疗的有效性。换句话说,治疗必须扭转现有的耳聋。这个由Saaïd Safieddine领导的团队,他是听力遗传学和生理学小组(巴斯德研究所/ Inserm)的CNRS研究员,也是该项目的协调员,使用了DFNB9的小鼠模型,DFNB9是一种人类耳聋的形式,代表了所有先天性遗传耳聋病例的2%到8%。
DFNB9耳聋是由耳费蛋白编码基因突变引起的,耳费蛋白是一种蛋白质,在毛细胞内突触传递声音信息方面起着关键作用。耳费素缺乏的突变小鼠严重失聪,因为这些突触在声音刺激时不能释放神经递质,尽管没有可检测到的感觉上皮缺陷。因此,DFNB9小鼠是测试病毒功效的合适模型基因治疗当它在晚期被使用时。然而,由于aav的DNA包装容量有限(约4.7千碱基),因此很难将该技术用于基因其编码区(cDNA)大于5kb的,如耳蕨基因编码区为6kb。科学家们通过采用一种被称为双AAV策略的AAV方法克服了这一限制,因为它使用了两种不同的重组载体,一个包含耳铁蛋白cDNA的5'端,另一个包含耳铁蛋白cDNA的3'端。
将该载体对单次在成年突变小鼠耳内注射,通过重组5′端和3′端DNA片段,重建耳ferlin编码区,使内毛细胞的耳ferlin表达长期恢复,进而恢复听力。
因此,科学家们已经初步证明了利用两种载体在耳蜗内进行碎片性cDNA病毒转移的概念,表明这种方法可以用于产生耳费素,并持久纠正小鼠的重度耳聋表型。
科学家取得的结果表明,DFNB9先天性耳聋患者局部基因转移的治疗窗口可能比想象的更宽,并提供了将这些发现扩展到其他形式的耳聋的希望耳聋.这些结果是一项专利申请的主题。
进一步探索













用户评论