精确靶向脂质体抑制三阴性乳腺癌,小鼠转移
大约15%到20%的乳腺癌为三阴性,这意味着她们缺乏雌激素、孕激素和2型人表皮生长因子受体。在所有乳腺癌中,她们的预后最差,治疗选择也非常有限。寻找一种能够区分癌细胞和正常细胞的治疗方法尤其具有挑战性。
一种全新的精准医疗策略科学的进步这带来了一丝耐人寻味的希望。波士顿儿童医院的研究人员和纽约城市学院(CCNY)的生物工程师们表明,在一个三阴性小鼠模型中,负载现有化疗药物的双靶向抗体引导纳米颗粒显著提高了肿瘤靶向性,减少了肿瘤和转移性生长,并显著提高了存活率乳腺癌.没有明显的副作用。
定制的目标
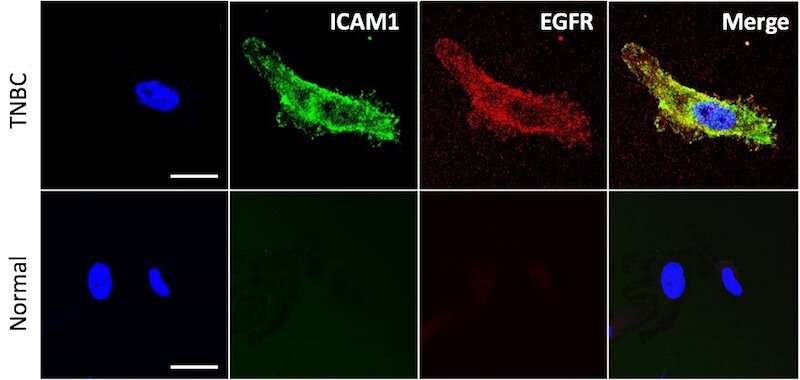
在波士顿Moses实验室儿童血管生物学项目的Peng Guo博士和Jiang Yang博士的带领下,研究人员首次对非裔美国人和白种人三阴性乳腺进行了细致的筛选癌症细胞系看看他们是否携带68种常见的癌症抗原。他们确定了16个潜在的靶点,所有被测试的癌细胞系都有,并在进一步评估后选择了两个最强的靶点:被称为ICAM1和EGFR的表面受体,它们在癌细胞中大量存在,但在非癌细胞中很少出现。
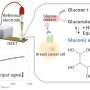
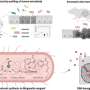
接下来,郭和杨确定了癌细胞上每种受体的相对数量和位置。ICAM1和EGFR受体的比例在细胞系中介于1.5:1到4.2:1之间,两者之间的比例非常接近。根据这些比例,团队进行了定制工程脂质体抗体以相应的比例靶向ICAM1和EGFR,这种技术被称为互补靶向。
“如果我们想选择性地将药物输送到肿瘤中,使用两个靶点的协同作用明显优于使用单一靶点,”血管生物学项目的主任玛莎·摩西博士说。“了解两个目标的分子比例和结构是成功的双重瞄准的关键。”
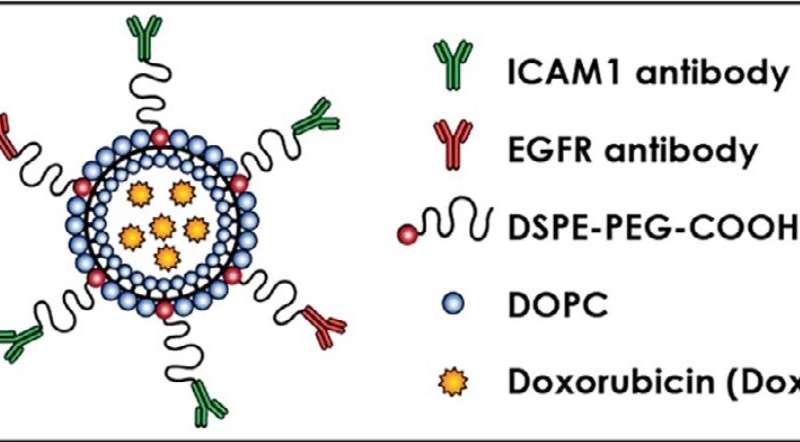
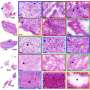
工程的双互补脂质体(DCLs)也包含两种脂肪脂分子,DOPC和DSPE-PEG-COOH,并装载阿霉素,一种fda批准的乳腺癌药物。通过显微镜观察,Guo, Yang和他的同事证实了脂质体专门定位于乳腺癌细胞并与它们的靶细胞结合。
“我们发现,更多的化疗药物被专门输送到肿瘤细胞,”郭说。“这达到了我们减少治疗肿瘤所需药物总量的目标,潜在地减少了三阴性乳腺癌患者化疗引起的不良反应。”
抑制肿瘤和转移
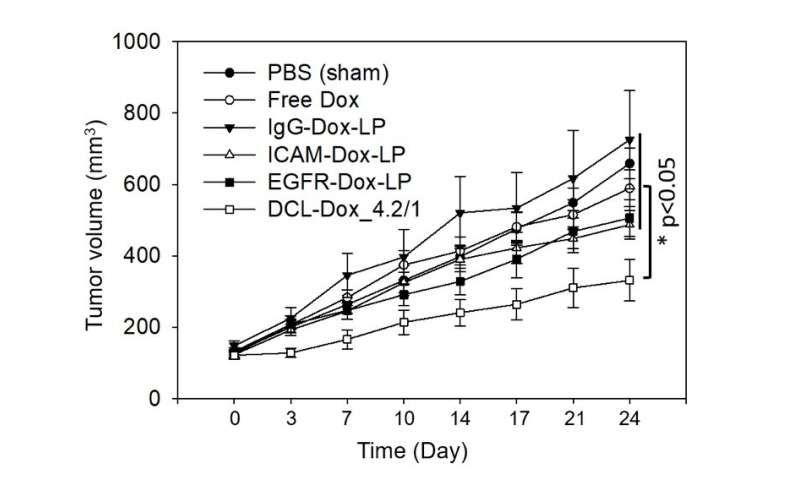
在小鼠实验中,与游离阿霉素(未包装在脂质体中)相比,DCLs抑制三阴性乳腺肿瘤生长约40%。它们也优于单纯靶向ICAM或EGFR的脂质体。
重要的是,脂质体还能识别并减少肺转移,肺转移是三阴性乳腺癌患者死亡的主要原因。尽管小鼠属于易发生肺转移的类型,但双靶向脂质体治疗的小鼠中没有一例发生转移,相比而言,单靶向ICAM1脂质体治疗的8只小鼠中有2只发生转移,单靶向EGFR脂质体治疗的8只小鼠中有6只发生转移。8只接受游离阿霉素治疗的小鼠中有5只发生了肺转移,所有8只未接受治疗的对照组也是如此。
寿命更长,无毒性
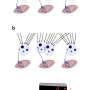
也许最显著的区别是生存能力。Kaplan-Meier曲线显示了不同治疗的无转移生存率。如顶部的黑线所示,DCLs治疗的小鼠存活时间最长,没有疾病进展。
研究人员通过检查动物的器官和血液化学物质,测量了不同剂量DCLs的“脱靶”毒性。他们没有发现肝脏或肾脏毒性的迹象,即使在最高剂量。
“癌症治疗的一个核心问题是如何设计治疗方法来区分癌症细胞正常细胞为了将副作用降到最低,”郭说。“用理性的方法选择目标组合作为‘条形码’进行识别癌症细胞是否有一种策略尚未应用于三阴性乳房癌症."
启动临床开发
研究人员已经为他们的技术申请了专利,他们说,这些技术可以作为一个平台,为其他癌症和疾病量身定制治疗方案。他们正在与一些公司进行谈判,以便将这一战略落实到临床开发脂质体阿霉素配方的成分以及ICAM1和EGFR靶点已经获得fda批准。
摩西说:“我们非常认真地致力于将这种技术应用于临床。”“这是我们实验室正在开发的针对难以治疗的癌症的更大的靶向疗法组合的一部分。”
郭和杨是这篇论文的共同第一作者。
进一步探索