Garp的故事:癌症免疫疗法的潜在目标
结直肠癌是男性和女性癌症相关死亡的第三大原因。根据美国癌症协会(American cancer Society)的数据,尽管治疗这种癌症的方法有了显著进步,但这种癌症的五年存活率只有12%。
免疫治疗已成为许多癌症的有希望的治疗,并且对黑色素瘤有效,肺癌,肾细胞癌.这些免疫疗法包括检查点疗法,如PD-1抑制剂,这有助于激活免疫系统对癌症.
尽管有承诺这些免疫治疗持有,涉及PD-1抑制剂的临床试验对结肠直肠癌令人失望。此外,只有一定突变的结肠直肠癌患者的患者似乎对抗PD-1治疗良好。
发表在三月号的一篇文章里癌症研究,紫菜李,M.D.,博士,博士和他的南卡罗来纳医科大学(Musc)的团队报告了针对结直肠癌的免疫疗法的潜在新目标。
与PD-1一样,Garp是在我们的免疫细胞表面上表达的蛋白质。李和他的团队希望靶向这种蛋白质可能是潜在的疗法结直肠癌没有回应其他免疫治疗的患者。
“就癌症治疗而言,免疫系统有这么多按钮,你可以推动,”李说。“PD-1检查点治疗是一个例子。研究人员不断寻找更多的按钮推动,我认为Garp可能是其中一个按钮。”
李教授是纽约州立大学微生物学与免疫学系主任,也是纽约州立大学霍林斯癌症中心癌症免疫学研究项目的联合负责人。
免疫系统中存在着一种重要的平衡。虽然我们需要免疫系统来保护我们免受癌症等疾病的侵袭,但我们也需要调节机制来防止它攻击我们的身体。这些统称为宽容。
癌症利用耐受机制来隐藏我们的免疫系统。T细胞是一种可靶向和杀死癌细胞的免疫细胞类型。然而,他们可以进入许多不同的口味。一种称为调节性T(Treg)细胞的一种味道,确保我们保持对我们自己的细胞的宽容。癌细胞可以增加Treg细胞的存在,以避免其他类型的T细胞杀死。
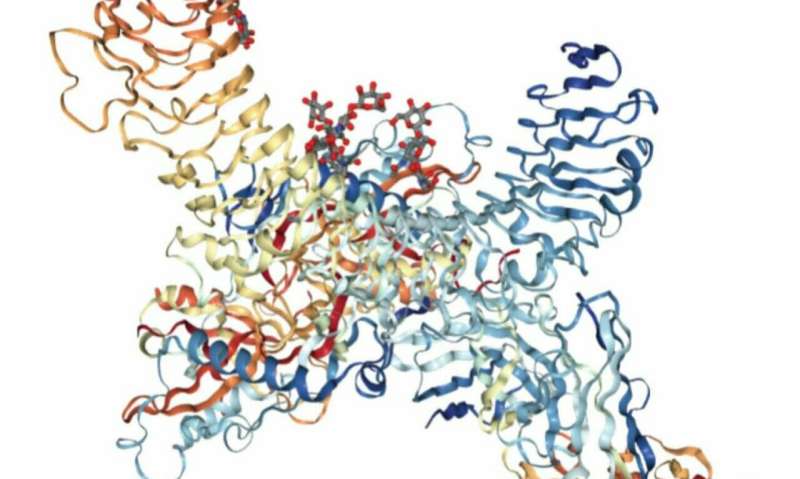
李和他的实验室一直对treg如何在耐受性和癌症等疾病状态方面进行调节感兴趣。Li领导的研究团队发现,在临床前模型中,干扰T调节细胞上的细胞表面受体GARP,会降低耐受性,减少结肠癌的发展,并抑制Treg细胞向肠道的迁移。
“从根本上说,我们揭示了基本的T调节细胞生物学,”李解释说。“我们发现,GARP,特别是T调节细胞上的GARP,对免疫耐受非常重要。它似乎还与肠道癌症的免疫逃逸有关。”
MUSC团队发现,在一个结肠炎小鼠模型中,Treg细胞上GARP的基因缺失阻止了免疫系统在肠道中保持最佳耐受。如果没有GARP, Treg细胞就不能有效地抑制免疫系统,进入肠道的Treg细胞就会减少。此外,研究小组还发现,与GARP完好的小鼠相比,删除结肠癌小鼠Treg细胞上的GARP,肿瘤减少了一半。
“在我们的临床前癌症模型中,在其Treg细胞上没有Garp的小鼠具有更好的结果,并且更多的T细胞渗透肿瘤,”李说。“有趣的是,肠道似乎只是这种情况。当我们在皮肤等其他地方诱导癌症时,小鼠在特雷尔细胞上没有Garp的小鼠之间没有差异。”
另一个参与Treg细胞调控的主要角色是TGF-beta。TGF-beta是由细胞释放的,可以调节免疫系统的不同部分。众所周知,GARP参与了tgf - β的激活。Li的研究表明,GARP和tgf - β共同调节Treg向肠道的迁移。
如果研究人员能够弄清楚结肠癌细胞是如何增加Treg向肠道的归航,他们就可以阻止这种归航信号。这将使免疫系统能够发现并根除癌症。
李和研究团队发现CD103,一种细胞表面蛋白,是归巢信号。
“当GARP在Treg细胞表面表达时,它可以抓取其他细胞分泌的tgf - β,”Li解释说。“这导致CD103表达上调,就像肠道中Treg细胞的邮政编码一样。”
最终,MUSC的团队首次展示了GARP在调节结肠中Treg细胞活性方面的作用。他们的下一步将是识别人类结肠癌Treg细胞上GARP的存在,因为GARP可以用于治疗。
“事实证明,结肠癌患者具有高水平的TGF-Beta,其上调Treg细胞”,李说。“这可能是他们对PD-1疗法没有反应的原因之一。然而,这些可能是抗garp治疗真正有效的患者。”
进一步探索











用户评论