在最早的时刻关闭致命的小儿脑癌
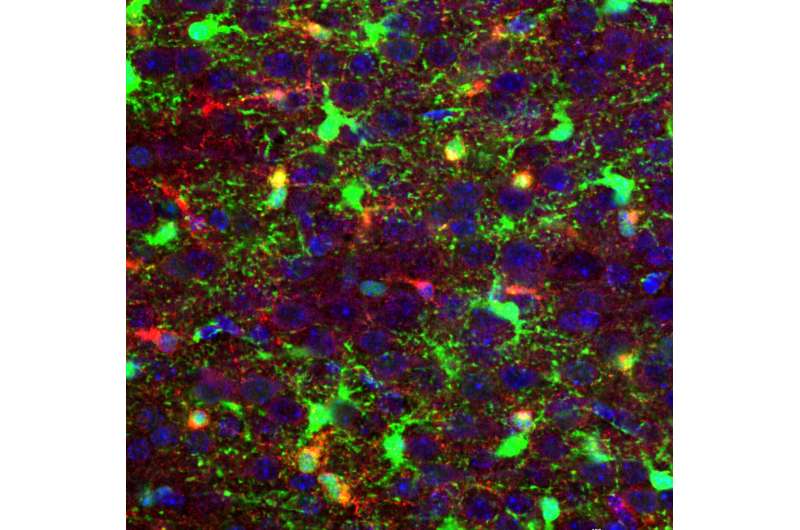
通过对新生小鼠和脑癌实验室模型中发育中的脑组织进行细胞遗传分析,科学家们发现了高侵袭性、致命且耐治疗的脑癌胶质母细胞瘤的分子驱动因素。
发表的调查结果细胞干细胞描述单细胞分析是如何识别对…至关重要的细胞亚群的胶质母细胞瘤形成 - 少突胚细胞的早期原始祖细胞大脑辛辛那提儿童医院医疗中心脑肿瘤中心的首席研究员和科学主任Q. Richard Lu博士说,细胞,prio - opc祖细胞。
该数据表明,原语寡核细胞祖细胞祖细胞的重新编程为干草状态在胶质瘤引发和进展中起重要作用。研究人员在研究中的主要分子靶标是一种叫做ZFP36L1的蛋白质,推出了在小鼠中镜像健康早期大脑发育的生物学计划,而是帮助燃料脑癌生长。Lu说,该发现提供了一个有机会发现新的治疗方法是否可以在最早的初始形成或复发阶段停止胶质母细胞瘤。
研究人员了解到,ZFP36L1-A蛋白质结合在一起不同RNA的蛋白质的缺点导致神经谱系祖细胞的迅速生长,使得它们随着它们转动癌变的快速生长的干细胞的性质。这尤其如此,对较少发达的原始寡核细胞祖细胞细胞尤其如此。该发现给了研究人员一个想法。
“当我们使用小的RNA干扰分子抑制小鼠和人胶质瘤肿瘤细胞中ZPF36L1基因的表达时,它显着降低了胶质瘤细胞生长和传播的速率,”卢说。“在具有胶质母细胞瘤肿瘤的小鼠中,ZPF36L1的遗传敲除显着增加了动物的存活时间。”
单细胞转录组学
研究人员使用单细胞转录组学作为他们研究的基础。这使得他们能够识别并比较每个正在发育的胶质脑细胞和正在发育的恶性胶质母细胞瘤细胞中的所有RNA分子。这包括不同种类的移行性少突胶质细胞和星形胶质细胞祖细胞,特别是支持胶质母细胞瘤快速生长的早期pre - opc祖细胞。
研究人员表示,这项研究很重要,因为在开发允许单细胞分析的新技术之前,引起高级胶质母细胞瘤的极其不同的遗传和类型的脑细胞已经难以钉住。
为了确定他们在小鼠胶质瘤模型中的观察结果是否适用于人类脑瘤的肿瘤形成,研究人员还分析了患者捐赠的人类肿瘤细胞的单细胞转录组。他们在人类少突胶质细胞祖细胞中发现了类似的种群和遗传特征。这些细胞已经退化到一个欠发达的有丝分裂状态,并假定快速生长的干样脑细胞的特征,为肿瘤的发生提供了条件。
临床前研究正在进行
研究人员强调,他们的数据是在小鼠和其他脑癌实验室模型中得出的,所以目前还不清楚这些结果是否能应用于患者治疗。不过,研究人员表示,这项研究确实提供了重要的线索,有助于与一种通常是致命的癌症(包括幼儿癌症)作斗争。
现在,Lu和他的同事们在实验室模型中发现,阻断由原始少突胶质细胞祖细胞形成的胶质瘤细胞中Zfp36l1的功能可以抑制胶质瘤的生长,他们正在扩大研究范围。他们想要找到一种有效的方法来治疗他们认为是一种新的潜在弱点的疾病,这种疾病到目前为止是不可战胜的。这包括未来开发更精确、更有效靶向Zfp36l1和大脑的特定治疗药物的工作细胞它有助于癌变。
进一步探索













用户评论