2019年5月24日功能
工程B细胞表达病原体特异性抗体以防止感染
抗体目前被用于治疗各种疾病,从癌症到自身免疫而且通常会多次给病人服用,很像药物。但是,生产和储存抗体它们的成本相对较高,因此人们对寻找替代策略来实现它们非常感兴趣。
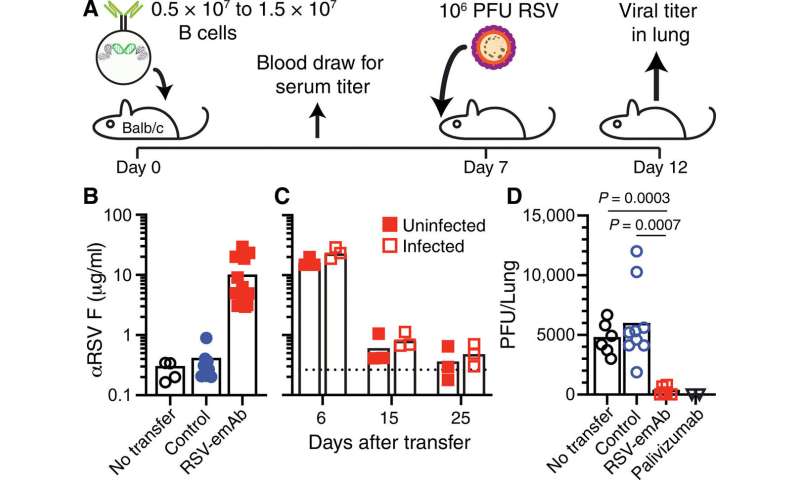
在最近的一项研究中,豪威尔F.Moffett和美国在美国的全球健康,免疫学,疫苗和传染病部门的跨学科研究团队。设计了人类和小鼠(老鼠)B细胞在实验室里。他们设计的细胞产生针对多种病毒的抗体,包括呼吸道合胞病毒(RSV)。科学家们表明,单一注射表达RSV特异性抗体的B细胞缺乏T和B细胞的小鼠待保护。这项新技术,现已发布科学免疫学,将开启使用工程师B细胞作为医疗保健的治疗方法的可能性。
目前还没有有效的疫苗可以终生预防许多常见感染,如RSV、艾滋病毒、流感病毒尽管研究了几十年的研究,但Epstein-Barr病毒(EBV)。在目前的工作中,Moffett等人。介绍了保护性的替代品疫苗通过发展一种遗传策略使用CRISPR-Cas9该技术可以用靶向RSV、HIV、流感或EBV的抗体替代内源性编码的原代人B细胞抗体。
他们观察到在内源的控制下,在原发性B细胞中观察到工程化抗体的有效表达监管要素表明细胞内相容性。细胞也保持正常的抗体表达和分泌。通过使用工程小鼠B细胞,他们展示了一个单一的B细胞工程表达一种对抗呼吸道疾病RSV的抗体转移如何产生有效和持久的保护RAG1有缺陷的老鼠。目前的做法为实现这一目标提供了机会消毒免疫针对传统疫苗迄今未能诱导或维持保护性抗体反应的病原体。
保护疫苗通过激活几种传染病,降低了人类死亡率降低了体液免疫应答用于后续生产高亲和力,病原体特异性抗体,产生B细胞。然而,研究工作仍在进行中,以提供对引起各种常见疾病的病原体的保护,包括RSV,一个常见的病原体感染上呼吸道和下呼吸道该病毒对婴儿、老年人、患有心肺疾病的人和正在接受造血干细胞移植的人具有威胁生命的影响。
虽然RSV候选疫苗的几种变体是在1966和2016时,他们无法引起长时间的保护反应。科学家们目前正在开发单克隆抗体为了类似地防止艾滋病毒,流感病毒,爱普斯坦 - 巴尔病毒(HBV),人颅骨病毒(HMPV),登革热,ZIKA病毒,埃博拉病毒等许多其他高风险病原体。保护性疫苗通常引发长寿命的B细胞和抗体分泌的血浆细胞,其中记忆B细胞表达抗体的膜结合形式。这些允许细胞在感染期间快速响应并分化到另外的抗体分泌细胞中。
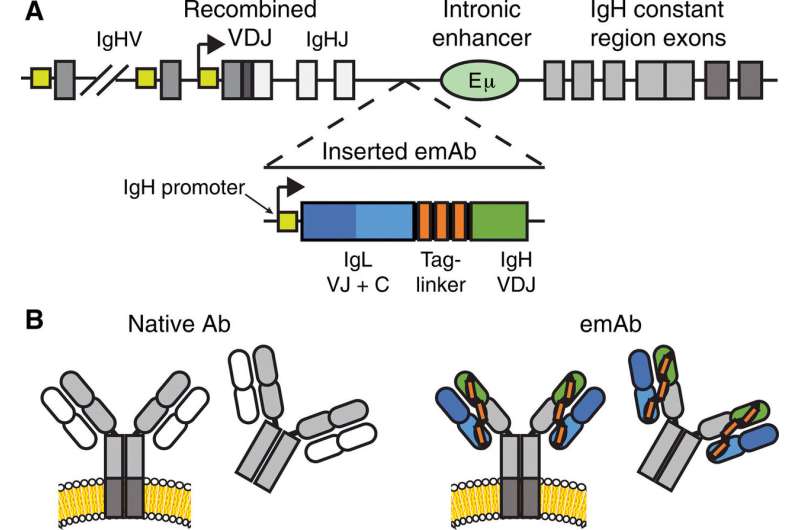
Moffett等人。制定了一种遗传工程策略以模仿有效的B细胞反应,其在内源性调节元件存在下,允许在小鼠或人B细胞中表达免受RSV,HIV,流感或EBV的保护抗体。全功能B细胞通常需要替代剪接和聚腺苷酸化产生膜结合和分泌抗体;这是一个具有挑战性的过程在病毒转基因中。添加另一层复杂性,抗体通常用两个基因产生;这重链基因(本;免疫球蛋白重链基因位点)和kappa (Igk)或λ (Igλ)轻链基因。由于IgH位点在表达B细胞的抗体中具有较大的体积和极端的遗传异质性,定位IgH位点是一项复杂的任务。
IgH位点包括V(可变),D(多样性),J(连接)和C(常数)片段,在每个细胞的B细胞发育过程中,在DNA水平上发生重组事件。之前的研究尝试要么取代了沉重的地区或者光区域对B细胞进行基因改造在目前的工作中,Moffett等人结合了之前的两种技术,通过开发一种单切方法将基因结构插入到一个intronic地区(IGH基因座的(RNA转录物的非编码区域)。使用这种方法,它们有效地设计了鼠和人体细胞。
为了实现一次性插入,科学家设计了一个工程化单克隆抗体(emAb)含有IgH启动子的磁带。在接下来的步骤中,Moffett等人通过基因工程使emAbs在内源性调控元件的控制下在膜结合区域内表达。
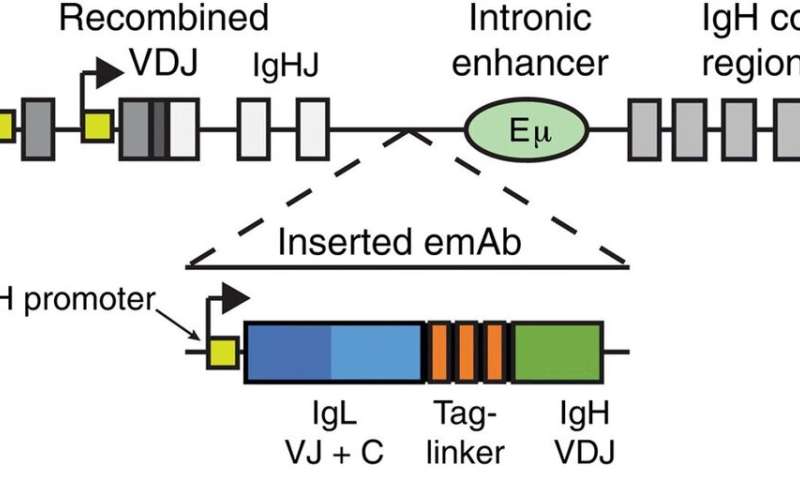
为了测试emAb(工程单克隆抗体)的插入和表达,科学家们在aBurkitt-kymphoma衍生的B细胞系本身表达膜结合的抗体。他们使用该基因组分析了基因组CrispRGold算法识别几个潜力Cas9指南RNA.绑定站点实施预期的基因工程。科学家首先将与Cas9蛋白质预先用来的细胞系电穿孔以实现有效的DNA切割。然后用腺相关病毒(AAV)孵育细胞,其编码了来自的工程化的RSV-Emab盒式磁带Palivizumab(为呼吸道合胞病毒设计的单克隆抗体)。
科学家们设计的实验只允许细胞结合呼吸道合胞病毒RSV抗原,如果RSV- emab盒能成功插入IgH位点。使用流式细胞术然后,他们评估了RSV-emAb在细胞表面的表达,结果显示emAb工程用功能性单克隆抗体重新编程了B细胞。
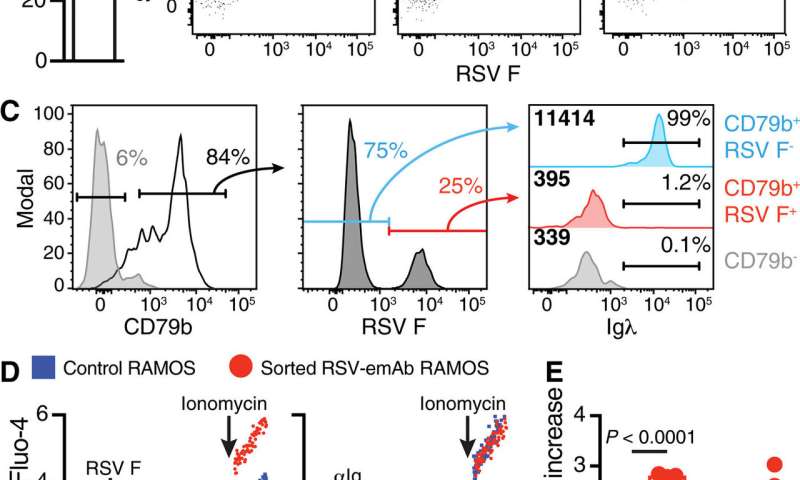
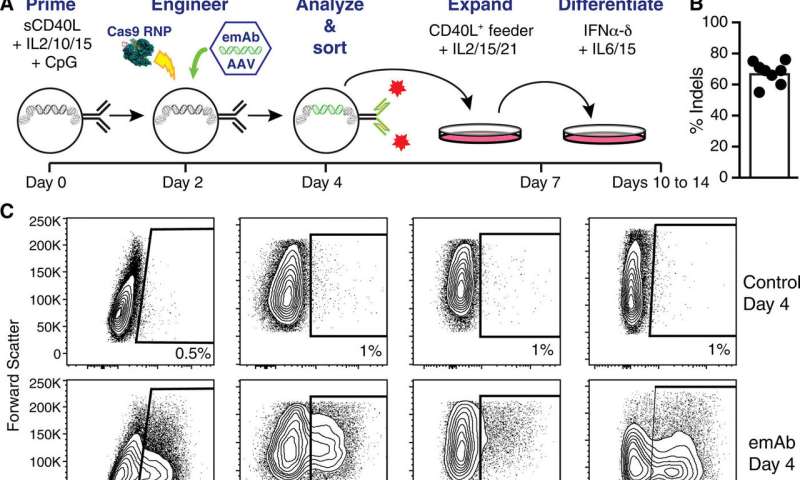
在下一步,Moffett等人。在用GRNA / CAS9电穿孔之前,用细胞膨胀和分化的工程化人的原发性B细胞。为了测试跨多个独立衍生的抗体的Emab骨干的性能,科学家设计了三种编码所列抗体的额外Emab盒,伴随着嘲弄工程控制B细胞。
- HIV-1广泛中和抗体VRC01
- 流感广泛中和抗体Medi8852.,
- EBV的中和抗体AMM01
科学家们展示了emAb平台在设计B细胞生产和分泌保护性单克隆抗体方面的灵活性。然后通过基因工程优化实验设置以表达这两个IgH位点。
在完成体外改造原代B细胞的实验后,科学家们下一步在感染的小鼠模型中测试它们在体内的保护能力。Moffett等人将基因工程的emAb B细胞转入免疫缺陷的RAG1后,能够维持40天的血清抗体水平-/-缺乏内源性T和B细胞的突变小鼠模型。由于emAb细胞的持续存在,工程细胞保护小鼠82天。然而,这些细胞对感染没有反应,科学家们认为这是由于缺乏T细胞的破布-/-突变的老鼠。
由于B细胞是在实验室中工程和培养的,它们可能没有获得记忆B细胞形成的特性,从而在动物模型中独立于T细胞的帮助做出反应和防止感染。因此,在未来,Moffett等人打算预先选择对T细胞依赖性较低的B细胞亚群,以改善细胞对感染的反应。
在免疫缺陷动物模型中进行的翻译实验代表了免疫缺陷造血干细胞受者观察到的疾病机制,这些受者在移植后容易受到感染。Moffett等人设想工程emAb细胞输注靶向RSV、EBV、HMPV.(人类metapneumovirus)和巨细胞病毒(巨细胞病毒)和缓解/规避疾病机制。与此同时,科学家们也在努力绕过病人特异性的体外细胞制备,提供过继细胞疗法通用供体细胞生产和NanoCarrier驱动原代细胞在体内的运输,以保证抗体的有效输送。
通过这种方式,Moffett等人展示了特异性和高效的小鼠和人类B细胞工程来产生多种有效的抗病毒体。这些工程B细胞中的修饰IgH位点保留了交替剪接的能力,并产生细胞表面B细胞受体和分泌抗体在动物模型转移后的保护水平。该技术将提供工程患者的可能性,以便将来对未来产生灭菌免疫力,以便尚未存在长期疗法或治疗的疾病。
进一步探索
Laura M. Walker等人。病毒感染的被动免疫疗法:“超级抗体”进入战场,自然评论免疫学(2018)。DOI: 10.1038 / nri.2017.148
Kunwoo Lee等人。Cas9核糖核蛋白和供体DNA的纳米颗粒转染诱导同源性DNA修复,自然生物医学工程(2017)。DOI:10.1038 / S41551-017-0137-2
Michel Sadelain等人。治疗性T细胞工程,自然(2017)。DOI: 10.1038 / nature22395
©2019科学欧宝app网彩X网络











用户评论