研究人员研究了通常在儿童中诊断的不治之症

大多数患有范可尼贫血的人在12岁之前就被诊断出来了,但活不过30岁。西维大学药学院和西维大学癌症研究所的研究员杜伟正在探索这种贫血的代谢过程。她的发现可能导致新的基因疗法,帮助患者活得更好,更久。
治疗一种顽固性血液病可能会导致孩子们的病情恶化能源生产西维吉尼亚大学的一项研究表明,在干细胞中。
药学院助理教授杜伟(音)正在研究干细胞产生能量的方式与范可尼贫血症的发生之间的联系。这种疾病使它更难骨髓大量生产血细胞我们的身体需要对抗疾病、止血和输送氧气。这也使得修复受损的DNA更加困难。
“几乎所有患范可尼贫血症的孩子最终都会患上白血病,”杜说,他是WVU癌症研究所亚历山大·b·奥斯本造血恶性肿瘤和移植项目的联合负责人。根据圣犹大儿童研究医院的调查平均寿命患有这种疾病的人年龄在20到30岁之间。
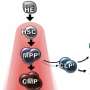
杜和她的研究小组发现,在范可尼贫血的动物模型中,干细胞倾向于使用需氧或氧基过程来产生能量。这是不寻常的:通常在骨髓和血液中发现的干细胞喜欢不依赖氧气的厌氧过程。
这种代谢上的区别表明范可尼贫血的不同症状——从疲劳和呼吸急促,到频繁的瘀伤和流鼻血——可能取决于细胞水平的能量产生。
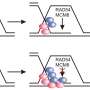
事实上,新陈代谢过程中的一个步骤似乎至关重要。研究人员发现了一种被称为p53-TIGAR轴的特殊信号通路,它在贫血模型中过表达。这种过度表达与干细胞能量生产的有氧“改道”有关。
目前范可尼贫血的治疗标准包括骨髓移植但正如杜教授解释的那样,这种方法的有效时间不到三分之一。她说:“凡科尼贫血症患者的血细胞并不是唯一发生突变的细胞。”“身体其他部位支持干细胞存活的其他细胞也是如此。”因此,患者的身体无法支持健康、移植正常的细胞的正常复制,他们的贫血症持续存在。
但是杜的发现可能会为范可尼贫血带来新的更好的治疗方法。一个有希望的选择是一种抑制p53-TIGAR信号过度激活的药物。防止p53-TIGAR的过度激活可以引导干细胞的能量生产回到正常的途径。
她的见解甚至可能加深研究人员对基因治疗技术的理解。“如果你对干细胞疾病有更多的了解——它们如何调节能量,如何调节分化和自我更新——你可能也能改善基因治疗,”杜说。“如果你能手动平衡疾病产生的能量干细胞那么当你收获这些基因传递细胞并将它们移植到患者体内时,这可能是一个好处。”
进一步探索










用户评论