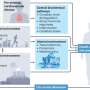
早期研究表明,开发有效的治疗胰腺癌的方法

胰腺导管腺癌(PDAC),最常见的形式胰腺癌是第五个最常见的原因在英国和死于癌症第三个在美国。死亡从PDAC超过乳腺癌尽管意义重大发病率的差异。
诊断和后期无效治疗的最重要的原因是这些暗淡的统计数据。
PDAC是一个积极的和难以治疗的恶性肿瘤。到目前为止,治愈的唯一机会是完整的手术切除肿瘤。不幸的是,由于PDAC通常无症状,80%到90%的患者疾病诊断手术不可治愈的时间。PDAC因此今天仍然是主要的生物医学的挑战之一由于其低利率大约是生存5%的病人还活着后五年的诊断。
然而,在最近几十年大量的研究已经阐明的发生和发展的分子机制负责PDAC。我们的最近的研究表明进展治疗是可能的。
无效的治疗方法
负责胰腺癌的分子机制是复杂的,这就是为什么最近个人化药物和免疫疗法的进步(帮助免疫系统对抗癌症)未能提高胰腺癌的治疗。这主要是由于两个特点:
- 95%的肿瘤是由喀斯特致癌基因的突变引起的。癌基因是基因,一旦能够诱导突变的转换正常细胞变成癌细胞。KRAS基因作为一个开/关开关。通常,它控制细胞增殖,但当它是变异,细胞开始肆意地生长,proliferate-a标志的癌细胞。到目前为止,喀斯特致癌基因已经无法有针对性的药物。
- PDACs四周都是多见间质丰富,纤维结缔组织生长在一些肿瘤类型。的PDAC,它形成了一个屏障,阻止细胞毒性T淋巴细胞(一种类型的细胞,可以识别和攻击肿瘤细胞)达到肿瘤的内部质量和杀死细胞。这使得免疫疗法治疗无用。
由于这些原因,PDAC继续与细胞毒性药物治疗,摧毁癌细胞,但同时也会破坏正常的细胞。选项包括Demcitabine1997年批准,Nab-paclitaxel,一个新的paclitaxel-based配方。即使这样的治疗是一种选择,它只延长病人的生命几周后,边际改善。
然而,近几十年来,许多研究已经揭示有关分子机制负责PDAC的发生和发展。
今天我们知道大多数的肿瘤是由喀斯特致癌基因的突变引起的。他们导致良性改变,导致一系列额外的突变肿瘤抑制基因通常修复DNA错误,减缓细胞分裂或告诉细胞什么时候死。突变时,细胞生长失控,在这种背景下发展为恶性PDAC。而这个过程是相对广为人知,它没有一个直接的影响的发展新的和更有效的治疗。
寻找新的策略
多种策略目前正在研究,试图抑制这些肿瘤的生长通过阻断肿瘤细胞或周围的增长“屏蔽”多见间质。在我们的实验室我们专注于阻断信号通路,调解启动喀斯特致癌基因的致癌活性。
十年前我们实验室决定使用转基因小鼠模型有生殖能力的人类的自然历史PDAC为了分析喀斯特的主要组件的治疗潜力的信号通路。这些研究公布了药物测试的原因迄今为止无法容忍的毒性作用,与老鼠死在几周内:他们的目标蛋白质的动态平衡状态的条件最优功能的细胞(称为状态正常的体内平衡)。
这些蛋白质主要是至关重要激酶,酶能够修改其他分子通过化学添加磷酸基,改变他们的功能。激酶发挥重要和复杂的作用在调节细胞信号,他们编排多个进程(激素反应,细胞分裂…)。这些结果可以解释为什么喀斯特信号测试迄今为止的抑制剂在临床试验中失败。另一方面,其他信号激酶的去除没有有毒副作用,但也没有影响肿瘤的发展。
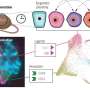
超过15的激酶参与从喀斯特致癌基因的传播信号,只有三个显示显著疗效不会引起不可接受的副作用。这些都是:RAF1,表皮生长因子受体(EGFR)和到。
它的工作原理!(老鼠)
在最初的研究中,我们观察到,消除(通过操纵基因)的表达一些这三个激酶预防发病PDAC喀斯特致癌基因造成的。然而,其消除对患有晚期肿瘤的动物没有显著的治疗效果。这些结果促使我们是否有可能消除多个激酶同时不增加毒性。
描述在我们最近的研究发表在《华尔街日报》癌症细胞、消除RAF1和表皮生长因子受体表达诱导的完整回归先进PDACs 50%的老鼠。我们目前正在研究我们是否可以增加这个比例也消除到。
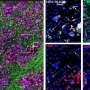
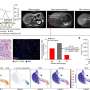
动物的胰腺的分析我们不再能够通过成像技术观察肿瘤病变的完全没有透露两个。两只动物显示一些异常导管,多组织残留可能残余肿瘤的疤痕。的其他小鼠肿瘤micro-masses一千原始肿瘤的大小。这些研究发现肿瘤细胞的存在,两个目标的表达,EGFR和RAF1,并没有完全消除,在这类研究中一个常见的技术问题。
值得注意的是,这些结果观察不仅在老鼠。这两个蛋白的表达的抑制作用细胞源于人类PDACs十之八九也能够阻止其扩散在活的有机体内当移植到免疫抑制小鼠以及在体外文化。
现在怎么办呢?
虽然这些结果只有被观察到在一个子集的老鼠,其重要性在于它是第一次已经可以完全消除先进PDAC肿瘤通过消除药物指导目标。
这些观察显然是重要的治疗发展的基于RAF1和表皮生长因子受体的抑制,但它们只代表第一步长,艰难的路要走。
首先,重要的是识别PDACs之间的差异,对合并后的消除RAF1和EGFR和耐药。作为我们的工作描述,分析这两种肿瘤类型显示,他们不活跃在同一个更超过2000个基因表达不同。
识别额外的毒性不增加抗肿瘤治疗的目标不是一件容易的事。
继续与转基因老鼠,我们的测试直接但同样困难的任务是具体RAF1的发展抑制剂。事实上,我们只有目前有效的药物对第二个目标,表皮生长因子受体。原则上,有四种可能的方法:
- 生成选择性抑制剂的激酶活性。
- 为其绑定生成抑制剂喀斯特致癌基因。
- 为其生成抑制剂相互作用效应的目标传输RAF1致癌信号介导的。
- 用药物降低RAF1蛋白质。
RAF1激酶抑制剂设计活动似乎是最实惠的选择,考虑到制药行业的经验设计这个分子类型。
问题所在,有两个相同的其他激酶家族,ARAF和BRAF的催化中心(酶)的“积极核心”几乎是相同的。RAF1激酶抑制剂也瞄准了这些其他激酶,造成间接伤害。测试到目前为止造成的高毒性和临床试验必须停止了。
继续开发有效的分子能够阻断RAF1 PDAC患者活动并非易事。它肯定会比我们希望花费更多的时间,但至少一个路线图已经概述了显示我们如何继续前进。