新的基因武器挑战镰状细胞病

对镰状细胞病患者的帮助可能很快就会来自基因编辑,以修复导致该疾病的突变,并提高患者自身的保护性胎儿血红蛋白。
新的研究表明,使用CRISPR-Cas9和纠正短DNA模板来修复镰状细胞突变在一个病人的造血干细胞(hsc)可能是有效和安全的。
莱斯大学布朗工程学院的生物工程师鲍刚与德克萨斯儿童医院、贝勒医学院和斯坦福大学合作开展了这项研究。这一发现是鲍和费雯·希恩(Vivien Sheehan)领导的一项新研究中的几项发现之一。费雯·希恩是贝勒大学(Baylor)的助理教授,也是德克萨斯儿童血液学中心(Texas Children’s Hematology Center)镰状细胞项目的成员。
这项开放获取的研究发表在《牛津学术期刊》上核酸的研究。
镰状细胞病是一种痛苦的、往往致命的遗传疾病,影响着大约10万美国人和全世界数百万人。血红蛋白亚单位(又名球蛋白)的一个单一突变会使正常的圆盘状红色血液细胞变硬并呈典型的镰刀状。这些细胞可以破坏血管壁并形成血栓小血管,停止向组织输送氧气。
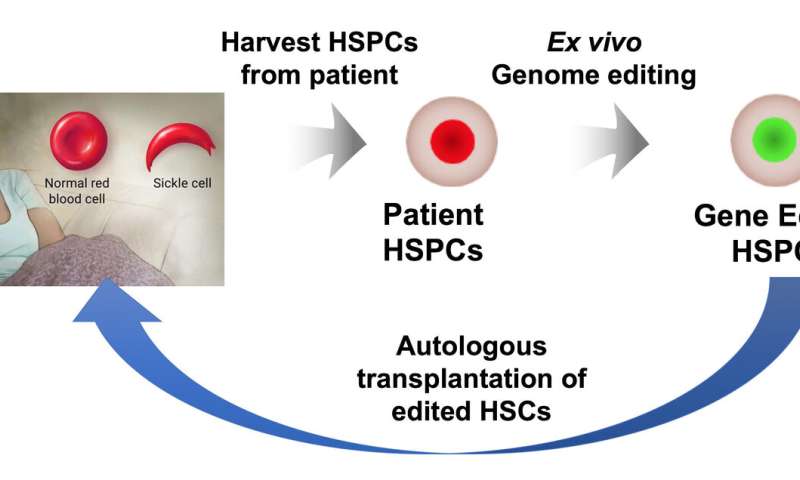
如今,一些患有此病的人使用来自匹配的、有血缘关系的捐赠者的干细胞进行治疗,研究人员表示,只有不到15%的患者可以使用这一选项。一个更好的策略是修改患者自己的造血干细胞和祖细胞(hspc),理论上每个患者都有这个选择,因为这样不会有排斥的风险。
理想情况下,对从患者骨髓中分离出来的干细胞进行基因编辑和测试,并使用化疗减少患者的干细胞,以便为编辑后的细胞腾出空间。包医生说,经过矫正的细胞将被植入患者体内,在那里它们可以增殖并产生健康的血细胞。
在这项新研究中,Bao和他的团队首次在啮齿动物中测试了患者的热休克蛋白,证明来自患者的部分基因编辑细胞可以存活并功能约4个月。
这些干细胞来自5名患者的外周血和2名患者的骨髓,均由Sheehan获得。Sheehan实验室描述了编辑细胞产生的血红蛋白类型,并表明基因编辑可以提供足够的保护性和正常的血红蛋白来防止镰状贫血,即使是在促进镰状贫血的严重缺氧情况下。
早期使用野生型Cas9蛋白(一种针对化脓性链球菌并切割特定DNA片段的“剪刀”)从化脓性链球菌中进行的测试导致了高水平的意外DNA编辑。这些偏离目标的编辑包括可能导致疾病的大量染色体缺失和倒置。
在第二轮测试中,莱斯实验室采用了集成DNA技术公司(Integrated DNA Technologies)开发的Cas9的“高保真”版本。鲍说,这大大减少了错误的编辑。
并非所有从镰状细胞突变患者身上分离出来的干细胞都能通过基因编辑修复。根据Bao实验室的实验,顶多能固定40%。在另一个50%的细胞,DNA被削减,而不是修复纠正DNA模板,但这似乎促进干细胞的胎儿血红蛋白的表达(住宅),一种由不同的基因不携带镰刀突变和出生后几个月通常是关闭的。
胎儿血红蛋白可以减弱镰状细胞病。Bao怀疑,如果编辑细胞中胎儿血红蛋白的表达持续,90%的干细胞从病人要么是镰状贫血变异被固定,要么是胎儿血红蛋白阻止镰状贫血。
“我们的希望是,如果我们从病人的hspc中取出一小部分骨髓并破坏剩下的细胞,然后编辑热休克细胞并将它们送回,基因修正和表达hbf的细胞的结合将足以治愈疾病,”包说。
他说,10%的干细胞继续产生镰状细胞应该不是一个大问题。“好消息是,正常红细胞的寿命大约是镰状细胞的9倍,”包说。这意味着随着时间的推移,大多数红细胞是正常细胞。这是我们希望看到的情况。”
研究人员尚不清楚通过减少血红蛋白来提高胎儿血红蛋白水平是否会带来长期的益处,还是会引发地中海贫血,地中海贫血是一种血液疾病,会减少血红蛋白的产生血红蛋白。“这是有风险的,我们需要更好地理解它,”包说。
目前也不清楚有多少人干细胞必须进行编辑,为患者提供长期的缓解。“我们不知道有多少比例的经过基因修正的造血干细胞可以有效治疗镰状细胞病,”他说。有人说只有百分之几,也有人说有百分之五到十。我的猜测是5%左右就足够了,但确切的百分比只能通过临床试验确定。”
他说,通往人体试验的道路还需要一段时间。“在技术方面,我们已经准备好进行临床试验,”他说。“但仅仅是获得试验批准就需要大量资源。我们需要汇编数据,并做更多的实验来解决安全问题。”
进一步探索














用户评论