人芯片模型测试癌症药物的疗效和毒性,用于治疗指标
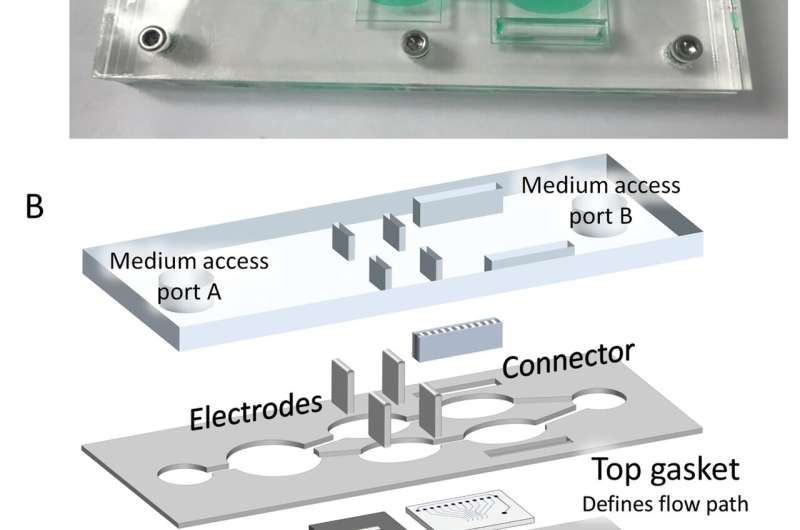
一种可重构的“芯片上的身体”模型可以通过同时测量靶细胞和其他器官(如心脏和肝脏)的复合功效和毒性来改变药物开发。这些发现发表在科学转化医学,证明了芯片上的身体模型能够通过更准确和有效的临床前测试,在不使用动物研究的情况下,真正彻底改变生物医学研究和个性化医疗。ob欧宝直播nba
佛罗里达生物技术公司Hesperos, Inc.与制药巨头罗氏和中佛罗里达大学(UCF)合作,表明其创新的多器官体外(体外)模型系统能够真实地复制母体药物及其代谢产物对抗癌治疗的体内(体内)反应,以确定单药和单药的治疗指数药物药物的组合。
治疗指数衡量的是药物的相对安全性和药物剂量的确定范围治疗效果在发生严重毒性之前。与此同时,对疗效的初步确定目前只能在动物临床前阶段进行,而动物模型并不总是能很好地指导药物在人体中的表现。
“这是临床前研究领域的游戏规则改变者药物开发UCF纳米科学技术中心教授,Hesperos首席科学家James J. Hickman说:“这一过程通常需要动物模型来测量治疗指数,在许多罕见疾病的情况下,由于没有可用的动物模型,需要在人类身上进行测试。”“此外,我们的系统将允许在特定癌症患者组织的小样本上测试不同的治疗方法,以帮助医生了解哪种治疗方法最适合每个人。”

“有了这个系统,药物化学家可以在动物前阶段用毫克量的化合物测试候选药物的多种变体。通常情况下,要进入动物体内,需要扩大规模,以制造出克到公斤的化合物,这通常会限制动物试验的一种候选人,因为它很昂贵,”康奈尔大学名誉教授、首席执行官兼总裁迈克尔·舒勒说。
据著名的同行评审科学杂志报道,Hesperos团队在两种情况下测试了他们的设备:在癌症来源的人类骨髓细胞系上进行抗白血病药物分析,以及在外阴和乳腺癌细胞系上测试多药耐药癌症的多药治疗。
对于这两种配置,我们开发了一种芯片上的人体系统,该系统能够在单一的循环无血清介质中容纳多种在生物微机电系统(bio-MEMS)模块上生长的人类衍生器官样组织结构,从而允许对人类替代品的反应进行无创测量。
对于白血病模型,将两种骨髓成分与肝组织合并,以测量两种抗癌药物双氯芬酸和伊马替尼对骨髓来源细胞的细胞抑制作用以及对肝脏的脱靶效应。测试表明,肝脏活力不受伊马替尼的影响,但双氯芬酸在第一种配置中降低了30%。

在第二种配置中,将一个耐多药外阴癌细胞系和一个无耐多药的乳腺癌细胞系纳入具有肝室的系统中,以确定代谢效应,并使用功能心脏模型来测量脱靶毒性造成的电气和机械缺陷。常见的乳腺癌药物他莫昔芬仅在经过肝脏处理后才会降低乳腺癌细胞的活力。他莫昔芬不影响外阴癌细胞,除非与维拉帕米(一种渗透性糖蛋白(Pgp)抑制剂)联合使用。他莫西芬单独使用和与维拉帕米联合使用均产生脱靶心脏效应,表现为收缩力、搏动频率和传导速度降低,但不影响生存能力。
这些结果与人体试验报告的结果一致。但这些实验都是在实验室进行的,不需要进行动物实验,对人类也没有风险。
Hesperos, Inc.是NCATS(国家先进转化科学中心)组织芯片项目中剥离出来的第一家公司,该项目成立于2011年,旨在解决与药物开发过程相关的长时间、高成本和高失败率问题。Hesperos目前由NCATS的小企业创新研究项目资助,以开展这些研究,并将组织芯片技术作为一家基于服务的公司提供。
NCATS特别项目副主任Danilo Tagle博士说:“组织芯片技术的众多用途之一是对候选药物的有效性进行临床相关评估。”
这些系统能够无创地评估心功能,并使用多剂量和重复药物给药方案监测生物标志物,这为癌症药物或药物联合给药的长期研究提供了机会。