蛋白质有望治疗帕金森氏症

对研究人员来说,帕金森氏症的真正病因仍然是一个谜,尽管他们知道,在许多患者中,一种名为α -突触核蛋白(aSyn)的蛋白质倾向于在脑细胞中聚集。但根据一项新的研究,一种不同的蛋白质可以帮助阻止这种聚集分子生物学杂志.
HYPE是人类发现的唯一一种Fic蛋白,它是一个关键的调控因子细胞在压力下生存或死亡。为了正常工作,蛋白质需要折叠成正确的形状。当细胞受到压力时,它们的蛋白质会发生错误折叠,这时它们会聚集起来并产生毒性。细胞通过评估其内部错误折叠蛋白质的数量来感知压力。
普渡大学生物科学助理教授Seema Mattoo说:“由于HYPE在细胞如何应对错误折叠蛋白质带来的压力方面发挥着如此重要的作用,我们想知道蛋白质错误折叠导致的疾病是否可能需要HYPE。”“我们在帕金森症中知道这一点疾病在美国,这种错误折叠的蛋白质通常是异步的。所以我们问HYPE是否可以修改aSyn,如果可以,会有什么后果?”
研究表明HYPE确实修改了异步——而且这种被称为ampyation的新修改减少了聚合。
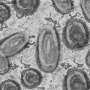
aSyn的团块,被称为路易体,是帕金森病的病理标志。聚集的aSyn会在神经元细胞膜上戳出小孔,从而导致神经功能下降,扰乱神经细胞的交流。
为了弄清楚aSyn的聚集程度越低是否就意味着戳出的小孔越少,马图与普渡大学(Purdue)的药物化学和分子药理学教授让-克里斯托弗·罗切特(Jean-Christophe Rochet)合作,用不同的脂质模拟一种膜,然后比较修饰过的和未修饰过的aSyn在膜上的表现。脂质中含有染料,如果戳洞,染料就会流出来。
“我们发现,经过修饰的aSyn释放的染料更少,这意味着细胞膜保持更完整,”马图说,他也是普渡大学炎症、免疫和传染病研究所和癌症研究中心的成员。“这意味着HYPE可能对帕金森氏症有治疗效果。”

在本研究之前,aSyn的ampyation,减少聚集,以前从未见过。蛋白质的许多修饰是自然发生的,但它们往往会增加聚集。
当Mattoo的团队在电子显微镜下观察经过修饰的aSyn时,他们也发现蛋白质的结构发生了变化。正常的aSyn倾向于扭曲,这可能会促进聚合。马图说,但是新的改良版本的纤维没有那么扭曲——它形成平行纤维,这可能是它聚集较少的原因。
每年约有6万名美国人被诊断患有帕金森症,约占60岁以上人口的1%。它表现为颤抖、僵硬、行走困难、平衡和协调困难,以及精神和行为变化。这种疾病无法治愈,但药物可以帮助减轻症状。
帕金森氏症很难治疗,因为人们对其真正的病因知之甚少,也没有人了解aSyn的真正功能。研究人员知道它的聚集促进了疾病,但为什么细胞允许它在第一个位置聚集呢?为什么aSyn会在那里?由于aSyn的确切生物学功能仍不清楚,研究人员对攻击aSyn犹豫不决蛋白质因为它对神经细胞的存活很重要。
“我们都试图在疾病发展的最后阶段贴上创可贴,因为我们知道聚合会导致细胞中毒,但我们如何预防呢?”Mattoo说。“在疾病的背景下,仍有很多关于它的机制有待理解。”
这项研究是在体外进行的,但下一步是将其转移到大脑细胞然后变成动物模型。
马图说:“我们还处于早期阶段,但这些结果为我们提供了一个观察潜在治疗方法的新角度。”“我们正试图研发出可以用来操纵HYPE活动的药物。你可以给那些开始表现出帕金森氏症迹象的患者或者那些容易聚集aSyn的患者。这是我们想要走的方向。”
进一步探索