蛋白质连接糖对于帕金森病相关蛋白质的摄取至关重要
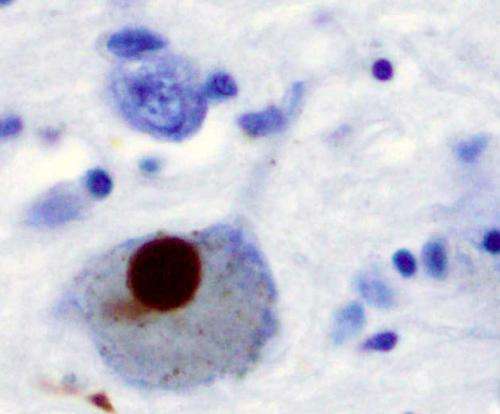
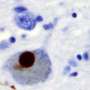
帕金森氏症是一种神经退行性疾病,影响着全世界超过600万人,其病因是大脑中α -突触核蛋白的积累。α -synuclein的生物学功能尚不清楚,但由于其在神经退行性疾病中的作用,研究人员正在积极研究该蛋白,以了解疾病的机制,并寻找新的治疗策略。
伊丽莎白·罗迪斯(Elizabeth Rhoades)和博士后梅丽莎·比罗尔(Melissa Birol)的一项新研究发现α-突触核蛋白与细胞外糖蛋白结合,蛋白质加入糖分子,它可以更容易地通过神经元占据。本文还确定了特定的突触前蛋白,Neurexin1β,作为该过程中的关键调节剂和潜在的治疗靶标。他们的调查结果发表在期刊上PLOS生物学。
在帕金森氏症的一个可能的病理模型中,α -突触核蛋白束(称为聚集体)在神经元内部形成。这就导致细胞死亡以及α -突触核蛋白簇的释放被其他神经元吸收。由于神经退行性疾病有典型的进展模式,了解阿尔法突触核蛋白如何在大脑神经元之间移动有助于研究人员了解疾病的传播。
罗迪斯实验室之前的工作暗示了一种多糖α-突触核蛋白的结合位点。这种发现与Birol在分析蛋白质 - 膜相互作用方面的经验,导致这项研究α-突触核蛋白如何与细胞膜相互作用。
比罗尔能够酶解去除特定的聚糖细胞表面为了了解他们的存在或缺席会如何改变神经元的α-突触核蛋白。研究发现,当除去聚糖时,细胞占用的α-突触核蛋白簇的量大大降低。
通过分析巨大的质膜囊泡,Birol还能够看到α -突触核蛋白和聚糖之间详细的物理相互作用。“α -synuclein与糖链结合有一个结构基础,当糖链被移除时,它改变了α -synuclein与糖链相互作用的本质细胞膜”,罗迪斯解释说。
该研究集中在乙酰化形式的α-突触核蛋白蛋白,其存在于健康和患病的神经元中,并且常常研究。他们发现乙酰化形式在形成神经元内的蛋白质簇中更有效,并且是与聚糖相互作用所必需的。“没有人真的强调了这些乙酰化版本的重要性,”Birol说。“一般来说,我们需要一步回到试图了解该蛋白质如何在细胞之间传播,并且我认为聚糖可能是一个方面。”
Rhoades和Birol说,最意想不到的发现是发现neurexin 1β作为α -synuclein如何被吸收的潜在伙伴神经元。他们希望未来对这种突触前蛋白的研究能够为帕金森病和其他疾病的治疗提供新的思路神经退行性疾病。
在近期内,Rhoades和她的小组希望获得与聚糖结合的α -synuclein蛋白的高分辨率结构信息。他们还希望这项研究将激发对α -synuclein乙酰化和聚糖在疾病进展中的作用的未来研究,并为研究以前未研究过的可能与帕金森病有关的蛋白质修饰提供动力。
“有些细胞会自发地内化这些[α -synuclein]蛋白,有些则不会。一般认为,在突触上有α -突触核蛋白特异性受体细胞这是内化聚集体。可能或可能不是真的,但[我们的研究]表明它不仅仅是蛋白质但是多糖也很重要,”Rhoades说。
进一步探索









用户评论