实验室研究确定了用ARID1A突变治疗人类癌症的潜在方法
一项新的研究表明,ARID1A-A蛋白质耗尽的肿瘤细胞,其作为癌症抑制剂的蛋白质对抗辐射处理后对抗癌聚合物核糖聚合酶(PARP)抑制剂药物感到高度敏感。研究团队建议,由约翰霍金梅尔癌症中心研究人员的研究领导,可以推进努力对许多人类癌症造成耐什么症,这是对当前标准治疗的损失。
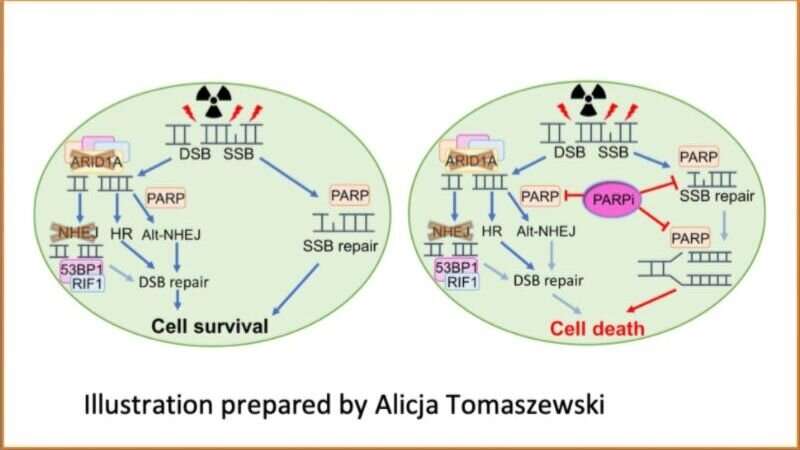
以前的研究表明,预防细胞生成ARID1A的ARID1A突变在约50%的卵巢透明细胞癌中发现,35%的子宫内膜子宫内膜腺癌和30%的卵巢子宫内甲型内癌。ARID1A突变也经常在肝脏,胃,膀胱和胰腺癌中发现。par抑制剂药物阻断PARP这种酶细胞用来发出信号和招募机器修理他们的DNA损坏,导致肿瘤细胞死亡。与修复系统完整的癌症相比,突变导致DNA修复系统缺陷的癌症往往更依赖于PARP。
一份关于这项研究的报告于6月13日发表在网上临床癌症研究。
“ARID1A突变在论文中非常普遍人类癌症。The goal of the study was to understand what ARID1A normally does in cells and which cellular functions are affected if it is lost due to inactivating mutations," says le-Ming Shih, M.D., Ph.D., Richard W. TeLinde Distinguished Professor in the Department of Gynecology and Obstetrics at the Johns Hopkins University School of Medicine, and co-director of the Women's Malignancies Disease Program at the Johns Hopkins Kimmel Cancer Center. "This allows us to develop effective treatments to eradicate cancer cells with ARID1A mutations or functional inactivation."
放射治疗通过不可修复地破坏DNA来杀死肿瘤细胞。如果ARID1A-deficient肿瘤显示响应照射+ PARP抑制剂在未来的临床试验,它可以提供一个新的机会来治疗一些癌症类型,没有很多有效的治疗干预措施,如卵巢透明细胞癌,晚期子宫内膜或胃癌症,他说。
在小鼠和人类子宫内膜癌或正常细胞的实验中,研究人员从细胞中删除了ARID1A,以确定缺乏ARID1A的细胞是否对分数敏感辐射。辐射会导致DNA损伤,通常用于治疗肝癌、胃癌、膀胱癌和妇科癌症。研究人员发现,如果没有ARID1A,一些细胞无法从辐射损伤中恢复并死亡,Shih说。
这些调查结果促使研究人员假设没有Arid1a的细胞无法有效地修复DNA。然而,由于单独的辐射治疗不会导致完全反应,因此研究人员随后测试了一种靶向DNA修复途径中的关键酶的药物的集合,以找到一个可能携手合作的辐射,使肿瘤细胞更脆弱。他们的努力出现了一类药物:PARP抑制剂。
然后,研究人员在小鼠体内建立了由人类癌细胞组成的肿瘤,并对小鼠单独使用放射疗法、PARP抑制剂、或两者联合或不治疗。他们发现,当荷瘤小鼠接受联合照射和PARP抑制剂治疗时,arid1a缺陷肿瘤显著缩小,但单独照射或单独PARP抑制剂治疗时,肿瘤没有明显缩小。这种抗肿瘤作用在治疗后持续较长时间。这种现象在arid1a熟练的肿瘤或正常组织中不明显。
虽然辐射治疗研究人员说,导致DNA断裂,具有完整DNA修复系统的癌细胞具有完整DNA修复系统的损伤,允许癌细胞继续分开。由于DNA修复在生物学中如此重要,所以存在冗余DNA修复系统。两种主要机制是非和谐的结束(NHEJ)和同源重组。在ARID1A - 突变细胞中,该研究发现NHEJ修复途径受到影响,这些癌细胞依赖于同源重组以维持肿瘤生长。他们的调查结果也解释了为什么Arid1a缺乏肿瘤仅部分响应放射治疗。当研究人员添加PARP抑制剂以抑制辐射后抑制同源重组修复,DNA修复能力在辐照的ARID1A突变中癌症由于NHEJ和同源重组机制均有缺陷,细胞受到阻碍。
“在ARID1A缺陷的肿瘤中,辐射诱导的DNA断裂不能有效修复,这将启动这些肿瘤细胞为了增强PARP抑制剂的脆弱性,“SHIH解释。
几种PARP抑制剂在临床上可获得并批准治疗BRCA突变相关的卵巢癌和乳腺癌。SHIH先前已经对ARID1A缺乏肿瘤进行了测试的PARP抑制剂,但对那些肿瘤的成功有限。新的研究可能有助于解释为什么,他补充道。
Given the clinical availability of PARP inhibitors and established clinical benefit of local irradiation, it is expected that the next step will be to determine this combination's safety and dose through a phase I clinical trial, according to co-authors Akila Viswanathan, M.D., M.P.H., M.Sc., interim director of the Johns Hopkins Department of Radiation Oncology and Molecular Radiation Sciences, and Stéphanie Gaillard, M.D., Ph.D., director of the Gynecologic Clinical Trial Center at Johns Hopkins.
进一步探索














用户评论