确认-淀粉样蛋白的直接毒性作用

大脑特定区域的过度活跃神经元被认为是阿尔茨海默病的早期扰动。来自慕尼黑工业大学(TUM)的一个团队首次能够解释这种早期重要的神经元功能障碍的原因和机制。他们发现兴奋性神经递质谷氨酸在活跃的神经元附近停留的时间过长。这导致了这些神经元的病态过度刺激——很可能是阿尔茨海默氏症患者学习和记忆受损的重要原因。
已经开发临床症状的阿尔茨海默氏症患者的大脑含有大块蛋白质β-淀粉样蛋白,称为斑块。许多治疗方法专注于去除斑块,但这种尝试迄今为止才会遇到有限的成功。
“我们早先发现和治疗疾病至关重要。因此,我们专注于多动神经元,在患者开发之前在很早的阶段发生记忆丧失,“哈尔特·康纳斯教授解释道,赫蒂斯·克隆教授,赫蒂高级教授在肿瘤中。由于多动激活的结果,电路中的连接神经元不断地接收错误信号,导致信号处理中的损伤。
与他的博士生Benedikt Zott和整个研究团队一起,Konnerth成功地确定了这种大脑早期紊乱的原因和触发因素。这一发现可能为新的治疗方法开辟道路。这项研究发表在该杂志上科学。
-淀粉样蛋白阻碍谷氨酸的再摄取
神经元使用称为神经递质的化学品彼此沟通。谷氨酸是最重要的这些化学品之一,用于活化连接的神经元。谷氨酸在两个神经元之间的连接部位释放,称为Synapse,而不是快速移除以允许下一个信号的传输。这种去除涉及所谓的主动泵分子以及被动运输谷氨酸沿着附近的膜。
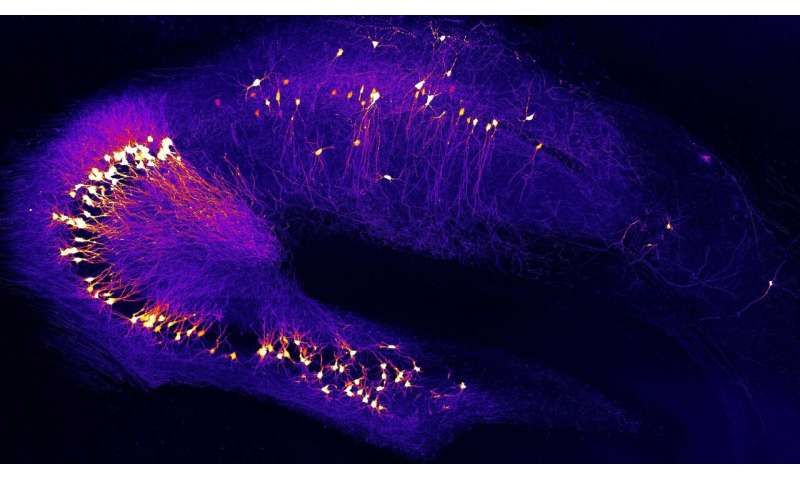
研究人员发现,高浓度的谷氨酸在过度活跃的突触间隙中持续时间过长神经元。这是由于β-淀粉样蛋白分子的作用,它阻断谷氨酸输送到突触裂缝中。该团队使用来自患者样品的β-淀粉样蛋白分子和使用两种方法获得类似结果的β-淀粉样蛋白分子测试了该机制。
早期治疗策略的适应症
该团队还感兴趣地发现神经递质阻滞是通过早期可溶性的β-淀粉样蛋白而不是斑块介导的。β-淀粉样蛋白最初作为单个分子形式或单体,然后聚集成双分子形式(dim)和较大的链条导致,最终在斑块中。研究人员发现谷氨酸封闭因子是由可溶性二聚体引起的。
“我们的数据为特定的快速和直接毒性效果提供了明确的证据β-淀粉样蛋白类型,二聚体。我们甚至能够解释这一机制,”该研究的第一作者本尼迪克特·佐特概述道。研究人员现在希望利用这些知识进一步提高他们对阿尔茨海默氏症细胞机制的理解,从而支持在该疾病的早期阶段制定治疗策略。
进一步探索












用户评论