研究人员前进寻求更安全,更简单的方式来提供助地的视野基因疗法
在对大鼠,猪和猴子的实验中,约翰霍普金斯医学研究人员制定了一种方法来向视网膜提供节能的基因疗法。如果在人体证明安全有效,该技术可以为常见疾病(如湿龄相关的黄斑变性(AMD)等常见疾病的患者提供新的,更永久的治疗选择,并且可能妨碍患有遗传性视网膜疾病的患者中的缺陷基因。
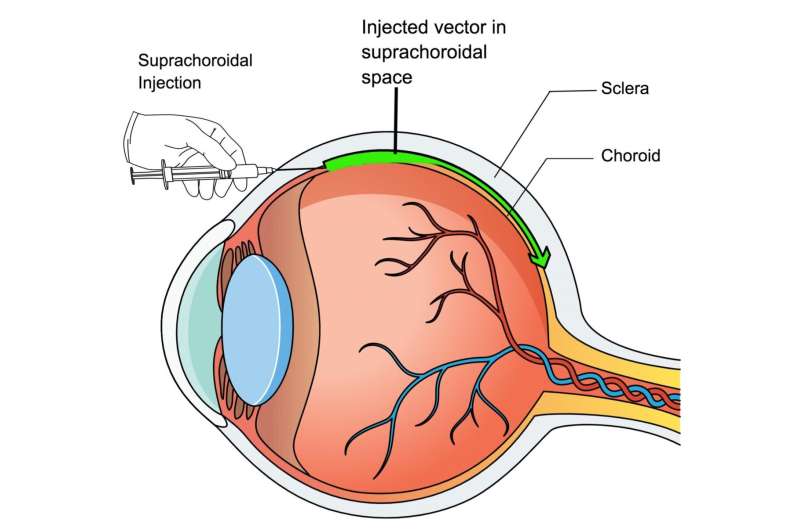
新方法,在8月13日下面描述的临床调查杂志,使用小针来注射无害的转基因病毒进入眼睛的白色和眼睛血管层之间的空间,称为Suprachoroidal空间。从那里,病毒可以在整个眼中传播,以将治疗基因递送到视网膜中的细胞中。
目前用于治疗Leber先天性黑龙病的基因治疗方法,一种遗传的眼部疾病,涉及一个外科手术在视网膜下注入携带基因的病毒。该程序携带高风险的患者发育白内障,以及视网膜脱离和其他视力威胁性并发症的低但显着风险。
虽然仅在此时在动物中进行测试,但新的Suprachoroideral注入技术侵入性较少,因为它不涉及分离视网膜,理论上可以在理论上脱离,它可以在门诊基础上进行,标志着制造永久视力源的主要步骤疗法更安全,更易于访问。
“患者遗传性视网膜变性的最佳时间基因治疗治疗是他们仍然具有相当良好的愿景。然而,当时,它们也有更多的并发症损失。在约翰霍普金斯大学医学院和Wilmer Eye Institute的眼科和神经科学教授Peter Campochochiadro,M.D.
据国家眼部研究所称,对年龄相关性黄斑变性的临床试验中,在临床试验中进行了对临床试验的临床试验中的测试,这是50岁以上50岁以上人的审查的主要原因。估计有1000万美国人有与年龄相关的黄斑变性。在这种疾病更常见的“湿”形式中,异常血管在视网膜下生长,并将视力阻挡液体渗入眼睛。异常血管的生长和泄漏是由于血管内皮生长因子(VEGF)的细胞信号过量产生引起的。
目前,眼科医生可以通过将蛋白质注入阻止VEGF的眼睛来避开视觉损失,但这些治疗的寿命有限,因此患者每四到六周返回诊所以进行更多的注射以维持他们的视力。错过的约会可以让异常的血管生长,导致进一步的视力丧失。
“我们发现重复的治疗虽然有效,但患者可以努力跟上,随着时间的推移,他们失去了愿景,”Campochiaro说。
然而,基因疗法可以将视网膜中的每种细胞转化为恒定产生抗VEGF蛋白的小药物工厂,从而连续保持视觉而不重复注射。
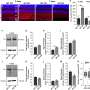
为了测试Suprachoroideral注射技术可以有效地向视网膜提供基因疗法,研究人员首先想追踪该技术是否能够允许病毒到达眼睛后部。研究人员用无害的腺相关病毒形式注射了10只大鼠的眼睛,以将荧光标记物携带到眼睛的Suprachoroidallal空间中。他们使用高功率的显微镜来跟踪视网膜的发光,发现一周后,病毒已达到整个视网膜。
接下来,研究人员看着这个病毒是否可以提供帮助基因。它们将抗VEGF基因加载到其修饰的病毒中,并将其注入到诱导的40只大鼠的Suprachoroidals空间中,以开发人类的黄斑变性形式的黄斑变性。为了比较,它们使用了40只大鼠的常规分子射流。
研究人员发现了suprachoroidal注射进行的技术以及传统的副血管域方法以及递送视觉保护抗VEGF蛋白的有效和长期持久。通过在猪和恒河猴中进行这些实验,研究人员证实了Suprachoroidal递送方法在更较大的动物眼中工作,较近人体的眼睛。所有结果都产生了类似的结果。
虽然这一点基因治疗是有希望的,Campochiaso指出,它可能不是以前暴露于这些实验中使用的病毒的人的选择,因为他们的免疫系统可能会在将货物交付之前停止病毒视网膜的细胞。然而,他认为,一天,Suprachoroidalloideral注射可能是大量湿AMD患者的可行选择和患有遗传障碍造成的患者缺陷基因。
“我们的希望是,对于Suprachoroidal的注射,患者可以刚刚走进诊所并获得透视的治疗,而不必担心子宫内注射的许多并发症,”Campochiaro说。
进一步探索













用户评论