追踪单神经元细胞的阿尔茨海默病病理
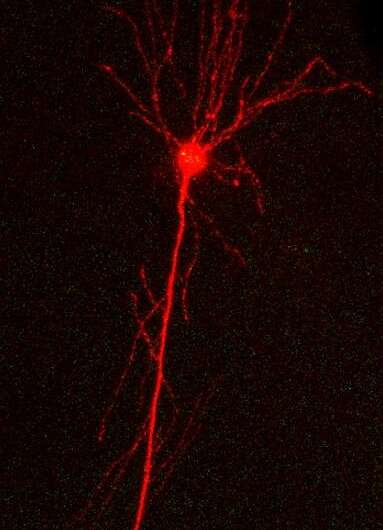
华威大学(University of Warwick)的研究人员开发了一种更先进的方法来描述阿尔茨海默病(Alzheimer's Disease)蛋白质对脑细胞特性的最早期影响。
在论文“Tau低聚物成大脑皮层神经元改变动作电位动态,破坏突触传递和可塑性,”发表在杂志eNeuro,研究人员直接确定新的治疗靶点,并为未来的研究活动描述一个新的标准。
阿尔茨海默病的特征是神经元外淀粉样蛋白斑块的积累和神经元内Tau蛋白的积累。Tau蛋白通常有助于神经元的稳定性和细胞内各种成分的运动。然而,有时它会发生变化,变得有毒。
Tau一开始是一个单体(a单分子),其中两个结合在一起成为二聚体,当少数几个结合在一起时,它们就成为低聚体,这被认为是破坏神经元的有毒物质。
这些tau寡聚物的精确作用仍有待确定,但华威大学(University of Warwick)的科学家已经开发了一种新方法,将低浓度的结构定义tau寡聚物直接引入大脑中的单个神经元。
这使得他们能够详细描述tau寡聚物的浓度和时间依赖性对神经元性质和它们通过神经元的运动的影响。特别有趣的是,tau寡聚体位于突触,神经元在此相互交流,并干扰了可能构成记忆的过程。如果Tau蛋白以单分子(单体)的形式引入,这些作用就会消失。
华威大学生命科学学院的马克·沃尔博士评论道:
“关键的发现是将tau寡聚物引入健康个体神经元在短时间内(约30分钟)产生显著效果。通过对连接细胞的记录,我们已经能够描述tau蛋白对细胞的影响突触传递以无与伦比的细节水平。
“更令人惊奇的是tau蛋白被贩运到突触和影响过程中,这可能是记忆的基础。”
因此,防止tau蛋白的寡聚化可能是一种潜在的治疗包括阿尔茨海默病在内的多种痴呆症的方法。
进一步探索
















用户评论