肾癌研究揭示了新的亚型和更好的诊断和治疗的线索
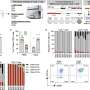
研究人员使用了最先进的基因组和蛋白质组学技术来整理它们的蛋白质基因组学特征,定义为基因组成(基因组学),DNA的化学修饰(表观基因组学),位于细胞中的信使RNA,作为模板制造蛋白质(转录组学),蛋白质(蛋白质组学)和它们的磷酸基修饰(磷蛋白质组学),一种已知的通过开关调节蛋白质功能的修饰。这项工作是作为国家癌症研究所临床蛋白质组肿瘤分析联盟(CPTAC)的一部分完成的,CPTAC是一个通过蛋白质基因组学更好地了解癌症的全国性努力。
研究人员说,在他们的发现中,3p染色体的丢失是ccRCC的明显标志,几乎在研究中所有的肿瘤样本中都有发生。
此外,研究人员根据免疫细胞差异确定了四种不同的基于免疫的ccRCC亚型,这些亚型可能用于帮助预测患者的总体生存期和对治疗的反应。
在所有肾癌中,ccRCC占75%,相当于每年约6.5万例新发病例。对于没有扩散到肾脏以外的癌症,手术切除仍然是唯一有效的治疗方法,但30%的患者在确诊时已处于晚期。
“历史上,ccRCC被认为对常规化疗和放疗有耐药性,对几种fda批准的药物的反应有限,”病理学和肿瘤学教授、约翰霍普金斯大学医学院生物标志物发现和转化中心主任Daniel W. Chan博士说。“美国国家癌症研究所的癌症基因组图谱(TCGA)已经对包括ccRCC在内的许多癌症的基因改变进行了分类,但问题仍然存在。”
“我们的研究结果说明了癌症我们可以使用蛋白质组学和磷蛋白质组学,除了基因组学,更多地了解癌症表型和它们的异质性,”张辉博士说,他是该研究的联合首席研究员,病理学和肿瘤学教授,约翰霍普金斯大学医学院质谱核心设施主任。
“使用一种分子研究来了解癌症已经不够了。需要一种多组学方法来完全描述癌症的特征,”该研究的主要作者和博士后David J. Clark博士说。
克拉克补充说,目前,不能通过手术治愈的ccRCC的一线治疗主要集中在抑制血管生成,这是癌症发展的过程新生血管以维持营养和生长,并针对一种名为mTOR的蛋白激酶,它有助于控制细胞的生存和分裂。他说,蛋白质组学和磷蛋白质组学数据的叠加使得研究人员能够检测出更广泛的潜在新药开发靶点。
分析的其他主要发现发现:
根据肿瘤微环境特征,ccRCC分为四种不同亚型:
- cd8阳性的炎症性肿瘤有大量的cd8阳性免疫细胞,并对与肿瘤相关的细胞信号通路有反应免疫反应.
- cd8阴性的炎症肿瘤几乎没有cd8阳性的免疫细胞,但有促进伤口愈合的成纤维细胞和对抗癌症和其他外来物质的巨噬细胞。
- 血管内皮生长因子(VEGF)免疫荒漠肿瘤没有免疫细胞,但在肿瘤进展中有大量与新血管生长相关的内皮细胞存在。
- 代谢免疫沙漠细胞更为纯净肿瘤几乎没有免疫的细胞细胞纤维母细胞很少。
Clark说,根据癌症基因组图谱的数据,cd8阳性炎症肿瘤患者的总体生存期较差,而VEGF免疫荒漠肿瘤患者的总体生存期最好。研究人员的新预测模型发现,cd8阳性肿瘤患者对免疫检查点疗法的反应最好,而VEGF免疫荒漠肿瘤患者对抗血管生成疗法的反应最好,这种靶向治疗会切断肿瘤与血液供应的联系。
张说:“总的来说,这项研究揭示了只有结合互补的蛋白质组学和基因组学分析才能获得的独特生物学见解。”“我们的多层次组学分析确定了在基因组水平上尚未完全捕获的潜在分子机制,并确定了对ccRCC患者进行分层所必需的蛋白质磷酸化和免疫标记,目的是开发更好、更有针对性的治疗干预措施。”
该团队下一步计划使用类似的方法更全面地描述胰腺癌和头颈部癌症。
进一步探索