威斯塔发现了促进脑转移的新机制

威斯塔研究所(Wistar Institute)的科学家们描述了一种新的机制,通过这种机制,大脑中最丰富的支持细胞星形胶质细胞也促进了癌细胞在大脑中的生长和转移。
根据该杂志在线发表的一项研究癌症的发现星形胶质细胞提供脂肪酸激活ppar - γ通路癌症细胞,促进它们的扩散。
脑转移仍然是晚期疾病患者总体癌症死亡率的一个重要因素,特别是肺癌、乳腺癌、结肠癌和肾癌以及黑色素瘤。目前的治疗策略已显示出有限的疗效,强调需要扩大我们的知识脑转移识别新的治疗靶点的机制。
“我们知道,癌细胞利用与局部细胞的相互作用,特别是星形胶质细胞,生存和增殖大脑免疫学、微环境与转移项目助理教授、该研究的高级作者陈庆博士说。“我们想了解这种相互作用的本质,以及星形胶质细胞究竟提供了什么来支持转移性生长。”
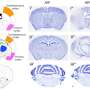
Chen和她的合作者专注于临床相关的黑色素瘤脑转移小鼠模型,发现星形胶质细胞促进癌细胞增殖。通过研究这种相互作用的分子机制,他们发现在具有更高形成脑转移能力的癌细胞中,过氧化物酶体增殖物激活受体- γ (ppar - γ)通路被激活,并且当这些细胞与星形胶质细胞共培养时,该通路更加活跃。
ppar - γ信号的遗传和药物封锁导致了降低癌细胞的生长以及对星形胶质细胞该通路在脑转移中的功能相关性。
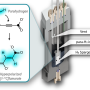
大脑是身体中脂肪最多的器官,富含支持其功能所需的多不饱和脂肪酸。星形胶质细胞是脂肪酸的主要细胞来源。研究小组发现,星形胶质细胞释放的多不饱和脂肪酸激活癌细胞中的ppar - γ信号,进而导致癌细胞增殖增强。
“我们的数据支持,脑转移细胞利用星形胶质细胞提供的高脂肪供应作为代谢和生长的营养来源,”陈氏实验室的博士后研究员、该研究的第一作者邹永康博士说。
重要的是,比较正常皮肤、良性痣、原发性肿瘤、颅外转移和黑色素瘤患者的脑转移样本,该团队证实了脑转移病灶中PPAR-gamma水平最高。
此外,治疗小鼠黑色素瘤和乳腺模型癌症PPAR-gamma抑制剂可降低脑转移负担,且耐受性良好。
“之前的研究表明ppar - γ在原发性肿瘤中具有抑制肿瘤的功能,”Chen说。“我们的研究表明,这种途径可能在转移中发挥相反的作用细胞并强调ppar -是控制脑转移的一个可行的治疗靶点。”
进一步探索










用户评论