加州大学洛杉矶分校开放针对最常见类型的淋巴瘤和白血病的CAR - T临床试验
免疫治疗领域已经彻底改变了无法治愈的癌症患者的治疗方式,挽救了许多人的生命,否则他们的疾病将被视为死刑。尽管它在治疗致命的白血病和淋巴瘤方面取得了成功,但仍有许多人没有从治疗中受益,或最终经历了癌症复发。加州大学洛杉矶分校琼森综合癌症中心的研究人员正在积极尝试开发新的方法,使这种疗法更好地适用于更多人。
本月,加州大学洛杉矶分校琼森癌症中心发起了一项开创性的研究嵌合抗原受体(CAR) T细胞免疫治疗试验,将攻击癌症细胞通过同时识别在b细胞淋巴瘤和白血病上表达的cd19和cd20。通过发起双边攻击,而不是使用传统的单靶点方法,研究人员希望最大限度地减少耐药性,并延长被诊断患有这些癌症的人的预期寿命。
“CAR - T细胞疗法在患者身上停止工作的原因之一是癌细胞通过失去CD19抗原而逃避治疗,这是CAR - T细胞被设计成靶向的,”Sarah Larson医学博士说健康科学他是加州大学洛杉矶分校血液学/肿瘤学的临床讲师,也是该试验的主要研究员。“保持CAR - T细胞工作的一种方法是有不止一种抗原作为目标。因此,通过同时使用CD19和CD20,我们认为它将更有效,并防止抗原的丢失,这被称为抗原逃逸,是耐药性的常见机制之一。”
在接受fda批准的CD19 CAR - T细胞疗法治疗后,多达三分之二的复发患者的肿瘤已失去CD19表达。加州大学洛杉矶分校的研究人员正在确定和测试像这样的新策略,以便更多的患者可以从治疗中受益。
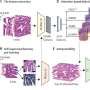
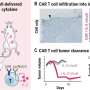
在Yvonne Chen博士领导的临床前研究中,她是微生物学、免疫学副教授分子遗传学在加州大学洛杉矶分校和该试验的赞助商,该团队能够证明,通过同时攻击两个靶点,在她的实验室开发的工程T细胞可以实现比传统的单靶点CAR - T细胞对小鼠肿瘤更强大的防御。
Chen的团队基于对CAR的结构、抗原结构和CAR/抗原结合相互作用的分子理解设计了CARs,以实现最佳的T细胞功能。这种设计有助于T细胞具有双重抗原识别能力,从而防止抗原逃逸。
“基于这些结果,我们非常乐观地认为,双特异性CAR可以实现目前可用的单输入CD19 CAR的治疗改善,”Chen说,他也是Jonsson癌症中心肿瘤免疫项目的联合主任,以及加州大学洛杉矶分校Eli和Edythe Broad再生医学和干细胞研究中心的成员。
这项首次在人类身上进行的研究将评估该疗法在非霍奇金b细胞淋巴瘤或慢性淋巴细胞白血病患者中的疗效,这些患者已经复发或对治疗没有反应。目的是确定一个安全的治疗剂量。
参加试验的患者将静脉内收集他们的白细胞(T细胞),然后在实验室中重新改造,使T细胞能够产生肿瘤特异性受体(CARs),使T细胞能够识别并攻击肿瘤细胞表面的CD19和CD20蛋白。新的“更聪明、更强”的T细胞随后被注入患者体内,开始识别和杀死患者癌症细胞.
这项试验使用的CAR - T细胞是在加州大学洛杉矶分校的实验室设计的。目前只有加州大学洛杉矶分校提供这项试验。
“虽然CAR - T细胞令人兴奋,使许多人受益,但大多数患者并没有治愈,”CAR - T细胞项目主任乔希·萨辛(Josh Sasine)医学博士说。“加州大学洛杉矶分校致力于推进CAR - T技术,造福于患有糖尿病的人癌症."
该临床试验由加州大学洛杉矶分校琼森综合癌症中心、美国国立卫生研究院和帕克癌症免疫治疗研究所合作资助。