具有分子多样性的脑疾病

帕金森病和多系统萎缩(MSA)这两种神经退行性疾病都与大脑中α -突触核蛋白的积累有关。德国神经退行性疾病中心(DZNE)和马克斯普朗克生物物理化学研究所(MPI-BPC)的研究人员研究了这些蛋白质沉积的分子组成,发现了结构多样性。来自韩国、澳大利亚和阿根廷的专家也参与了这项研究。研究结果发表在科学杂志上自然通讯,表明帕金森氏症可能与不同类型的蛋白质聚集有关。
突触核蛋白是蛋白质这在身体中自然发生。假设它参与神经元之间的信号传递。这种蛋白质既出现在细胞膜上,也出现在细胞内部的溶液中。除了这些“正常的”变异外,还有一些在脑部疾病中表现出来的变异。这适用于帕金森症疾病和MSA。两者都可能与神经损伤有关,包括运动障碍。在帕金森症和MSA中,α-突触核蛋白分子粘在一起。结果,细长的聚集物沉积在神经元和其他脑细胞内。
“这些沉积依次出现在大脑的各个区域。它们是一种疾病的标志,”Markus Zweckstetter教授解释道,他是DZNE和MPI-BPC的一个研究小组的负责人。“有证据表明,这些聚集物对神经元有害,并促进疾病进展。”
折叠的问题
这些沉积物代表了药物开发的一个潜在起点。他们的想法是,药物可能会阻止α -突触核蛋白分子粘在一起或溶解现有的聚集物。为了确定代理的潜在停靠地点,需要关于聚合体精细结构的数据。因此,问题是:分子在聚合体中采用什么样的形状(也称为“折叠”)?
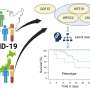
到目前为止,关于这一主题的信息仅限于实验室实验的数据。“之前的研究调查了在试管中合成的聚集体的分子结构。我们问自己,这种人工制作的标本如何反映病人的情况。这就是为什么我们研究从组织样本来自患者,”Zweckstetter说。“我们在这个项目上与国际合作伙伴密切合作。事实上,组织样本来自澳大利亚,聚合物是在韩国合成的。然后我们在Göttingen上做了结构研究。”
研究人员检查了5名已故帕金森病患者和5名已故MSA病患者的脑样本。为了进行比较,研究人员使用标准程序人工生产了α -突触核蛋白聚集体的变体。为了比较聚合体的结构,他们使用了核磁共振波谱和其他方法。
结构上的差异
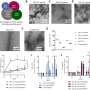
“我们发现,来自实验室的聚合蛋白与从患者材料中生成的所有聚合蛋白在结构上不同,”该研究的第一作者Timo Strohäker博士对这些发现发表了评论。此外,MSA患者的蛋白质与帕金森患者不同。如果你仔细观察数据,你会注意到MSA患者的蛋白质都有大致相似的形状。帕金森氏症患者的蛋白质更不均匀。当比较个体帕金森患者的蛋白质时,存在一定的结构多样性。”
所有聚集体的α -突触核蛋白都含有β片,这与之前的研究一致。因此,分子的主干被扭曲,蛋白质基本上是二维的。在聚合体中,蛋白质层层粘在一起。然而,折叠并不包括整个蛋白质。每个蛋白质也包含非结构化的区域。β薄片的方向很重要:“这是一个蛋白质折叠多少以及如何折叠的问题,”Zweckstetter说。
帕金森症中的各种聚集物
在与帕金森病相关的α -突触核蛋白的结构上,患者之间存在一些显著差异。这可能是因为帕金森症的病程因人而异。
“帕金森病的可变性可能与聚集α -突触核蛋白折叠的差异有关。这与“一病一株”假说相反,即帕金森病与一种明确定义的集合形式有关。然而,鉴于我们的样本相对较小,只有5名患者,这只是一个猜测,”Zweckstetter说。“然而,我们的结果肯定证明,对患者组织样本的研究以一种合理的方式补充实验室实验是必要的。”