美国出人意料地决定批准肌肉萎缩症的药物
美国卫生监管机构批准的第二个药物一种衰弱的肌肉萎缩症,意外决定药物安全问题而遭到拒绝后仅仅四个月前。
执政的第二次美国食品和药物管理局已经批准了初步批准基于早期结果的疾病,可能会引发问题的标准结算很大程度上未经验证的药物。
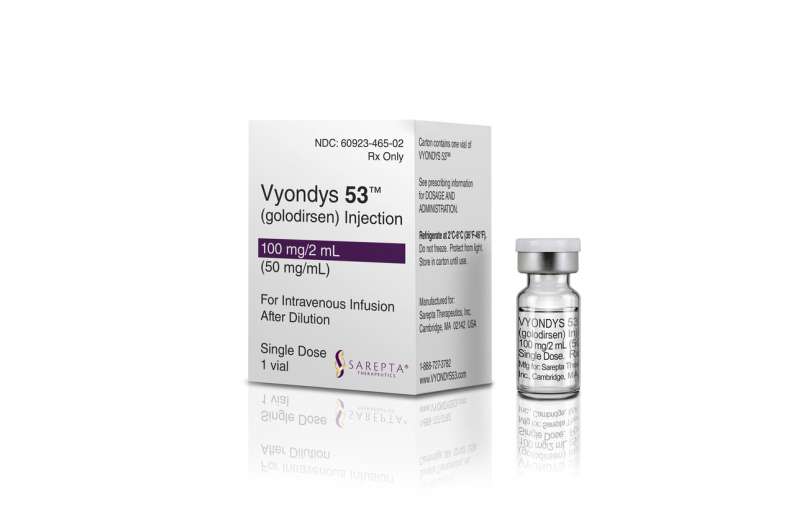
FDA说周四晚间批准Sarepta疗法的患者Vyondys 53 Duchenne肌肉萎缩症的一种形式。杜乡的影响在美国大约每3600个男孩,导致肌肉无力,丧失运动和早期死亡,通常当病人在20多岁或30多岁。特定类型的药物是影响大约8%的男孩与杜乡的。
今年8月,美国食品和药物管理局拒绝出现注射药物,发送给公司标记的风险感染和肾损伤病例在动物研究。但Sarepta争议的决定,提高FDA的药物中心领导。公司重新提交应用程序和数据,FDA改变了决定,根据Sarepta新闻稿。
美国食品和药物管理局周四说医生应该监测肾功能的病人服用药物。药物最常见的副作用包括头痛、发热、腹痛和恶心。其他反应包括皮疹、发热、荨麻疹、皮肤过敏等。
惊喜批准派遣公司周五股价飙升逾36%。但一些华尔街分析师表示,建议放宽标准的批准。

“鲁莽的决策机构不激发信心,在我们看来,“分析师Debjit将在给投资者的报告中写道。
这是第二次Sarepta药物批准了一个不寻常的路径。2016年,FDA领导人扫清了公司的第一个肌肉萎缩症的药物,否决机构评论家表示,几乎没有证据表明它奏效了。决定也跟着密集游说活动的病人的家庭,政治家们和医生。机构的批评建议FDA可能会屈服于外部压力。
Vyondys收到“加速审批”基于初步结果显示它能提高蛋白质,艾滋病的增长肌肉纤维。但药物尚未被证明能够改善病人的流动或健康。FDA要求Sarepta进行后续研究药物的这些措施。如果公司未能显示药物帮助病人,FDA可以撤回approval-though很少这样做。
的后续研究Vyondys预计,到2024年。药物每年将花费300000美元为典型的吸干净的孩子体重44磅,该公司表示。这是相同的价格Sarepta早期的药物。
分析师表示,意想不到的决定可能预示着其他可疑的实验性药物研究结果,其中包括备受关注的阿尔茨海默氏症的药物,药物很快就会先于该机构。
药物的开发人员10月公布的业绩显示药物可能是第一个智力下降缓慢阿尔茨海默氏症。但是许多专家都持怀疑态度,并指出不同寻常的变化研究和分析中使用药物的发展。
©2019美联社。保留所有权利。